
����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g����H2��g��![]() CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK ��_________________________________��
��2���÷�Ӧ������ӦΪ____________��Ӧ������ȡ��������ȡ�����
��3��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2����c��H2����c��CO����c��H2O�������жϴ�ʱ���¶�Ϊ______________�档���¶��¼���1molCO2(g)��1molH2(g),��ַ�Ӧ���ﵽƽ��ʱ��CO2��ת����Ϊ__________��
��4����800 ��ʱ������������Ӧ��ijһʱ�̲�������ڸ����ʵ�Ũ�ȷֱ�Ϊc(CO2)Ϊ2mol/L ��c(H2)Ϊ1.5mol/L��c(CO)Ϊ1mol/L, c(H2O)Ϊ3mol/L���������淴Ӧ���ʵıȽ�Ϊ����________���� ������������������������=����
���𰸡� c(CO)c(H2O)/c(CO2)c(H2) ���� 830 50% ��
����������1��CO2��g����H2��g��![]() CO��g����H2O��g�����仯ѧƽ�ⳣ��K= c(CO)c(H2O)/c(CO2)c(H2) ����ȷ����c(CO)c(H2O)/c(CO2)c(H2)��
CO��g����H2O��g�����仯ѧƽ�ⳣ��K= c(CO)c(H2O)/c(CO2)c(H2) ����ȷ����c(CO)c(H2O)/c(CO2)c(H2)��
��2���ɱ������ݿ���֪���������¶�ƽ�ⳣ������˵�������¶�ƽ�������ƶ����������¶�ƽ�������ȷ�Ӧ�ƶ�������ӦΪ���ȷ�Ӧ����ȷ�𰸣����ȣ�
��3��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2��c��H2��=c��CO��c��H2O����˵��ƽ�ⳣ��K=1�����¶�Ϊ830�棻CO2��H2����ʼ���ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ������ƽ��Ũ����ȣ��������������Ϊ1L����ƽ��ʱCO��g����H2O��g��Ũ������Ҿ�Ϊxmol/L, ��CO2��g��+H2��g��CO��g��+H2O��g����Ӧ��֪��ƽ��ʱ c��CO2��=c��H2��=1-x mol���ɽ��ƽ�ⳣ��K= c(CO)c(H2O)/c(CO2)c(H2)=1��x2/(1-x)2=1��x=0.5mol���ʶ�����̼��ת����Ϊ0.5/1��100%=50%����ȷ�𰸣�30��50%��
��4����ʱŨ����Qc=1��3/2��1.5=1>800��ʱƽ�ⳣ��K=0.9����Ӧ���淴Ӧ���У���v��������v���棩����ȷ�𰸣�����


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������и��仯�У���Ӧ��Ϊ�����µķ�Ӧ��A��C��D������Ԫ�أ���A����Ԫ�صĻ��ϼ۽���C��D֮�䣬E������Ϊ��ɫ��ζ��Һ�壬FΪ����ɫ��ĩ��GΪ��������ɫ���塣
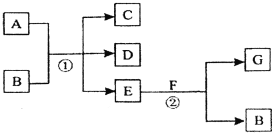
�ش��������⣺
(1)A��G�Ļ�ѧʽ�ֱ�Ϊ________________�� ________________��
(2)F��E��Ӧ�Ļ�ѧ����ʽΪ____________________________��
(3)д����Ӧ�ٵĻ�ѧ����ʽ____________________________________��
(4)�ڷ�Ӧ���У�ÿ����2.24 L����G(��״��)ʱ������F ___________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѻ�����狀�����淋Ļ��Һa L�ֳ����ȷݣ�һ�ݼ��뺬b mol NaOH����Һ�����ȣ�ǡ�ð�NH3ȫ���ϳ�����һ��������c mol BaCl2����ʹSO42����ȫ��������ԭ��Һ��NO3�������ʵ���Ũ��Ϊ�� ��
A��![]() B��
B�� ![]() C��
C�� ![]() D��
D�� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ķ����ģ��ش����⡣
ȼ���̻��������ҹ��Ĵ�ͳϰ�ף��̻��������Ҫ�ɷ��кڻ�ҩ����Чҩ���ȡ�

�ڻ�ҩ������أ�KNO3������ƣ�S����ľ̿��ɣ�
ȼ��ʱ��˲������������壬ͬʱ�ͷŴ����ȣ������Ŀռ����������Ѹ����������ը����Чҩ������һЩ����Ԫ�أ�ȼ��ʱ���������ͷĻ��档������ͼ��ʾ��
�±�Ϊ���ֽ���Ԫ�صĻ�����ȼ��ʱ�Ļ�����ɫ��
��������Ԫ�� | �� | �� | �� | � |
������ɫ | �� | ש��ɫ | ���� | �� |
Ȼ������ͳ���̻���������Ⱦ������Ҳ����ɸ����˲м������¹ʡ�Ϊ�˸��ƴ�ͳ�̻�����IJ��㣬����Ϊ���ǵļѽ�ף�ˣ����ӱ���Ӧ�˶�����Ŀǰ�������ĵ��ӱ�����������ʽ��
��һ����ʽ������ӱ��ڣ������ܷ�����ͨ���ڵ�ģ���������һ��ܷ������⣬�Լ����档��ҩ������Ⱦ�����ᷢ���˲м������¹ʡ����ظ�ʹ�ã������پ���֧���������������Ҫʹ�ü��õ�Դ���������ƶ���
�ڶ������ӱ��ڻ�����һ��ʹ��ú�����������������Ϊȼ�ϵ��豸����������ҩ�������죬��ȱ���ǵ�ȼ�������ʱ����һ���İ�ȫ������
������¼�����ڣ�ͨ����Ƶ���벥�Ŵ洢��оƬ�еı���¼���������빦�ʴ�С�йء����ֱ��ڵ��ŵ��Ǵ����ܡ����ƶ�����۵�����ȱ���Ƿ���ͷ�Χ�ж��Բ
���͵��ӱ������ڲ��ϵر��з����������õشٽ�������Ƽ����ںϡ�
�������ģ��ش����⣺
��1����ȼ���̻��Ļ�����ֻ���ɫ�����̻��п��ܺ���______Ԫ�ء�
��2����ʽ������ӱ��ڵ��ŵ���______������ţ���
A����ҩ������Ⱦ
B�����ᷢ���˲м������¹�
C�����ظ�ʹ�ã����پ���֧��
��3���ж�����˵���Ƿ���ȷ����ԡ���������
��ȼ���̻�����ʱ������ͬ��ɫ�Ļ��棬����Ϊҩ���к��в�ͬ�Ľ���Ԫ�ء�______
��ȼ���̻��������ŵ��̼��Ե���ζ������Ϊ�����˶�����̼��______
�۵��ӱ��ڻ��ڵ�ȼ�������ʱ����һ���İ�ȫ������______
��¼�����ڵ�������С�빦���ء�______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ������֪���ʵ���Ũ�ȵı�����ⶨδ֪���ʵ���Ũ�ȵ�NaOH��Һʱ��ѡ�������ָʾ��������д���пհף�
��1���ú����������ʣ����ʲ������ᷴӦ���Ĺ����ռ���Ʒ����500mL��Һ�����ձ�����Ͳ����ͷ�ιܺͲ������⣬����Ҫ�IJ���������___________��ȡ��25.00mL����Һʱ��Ҫ��������_____________��
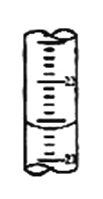
��2���ζ������У�����ƿ��һ�Ű�ֽ��������_______________������ѧ����ʵ������У���¼�ζ�ǰ�ζ�����Һ�����Ϊ0.50mL���ζ���Һ����ͼ(�������֣�22���������֣�23)�������ʱ���ı���Һ�����Ϊ_________mL
��3�����в����п���ʹ����NaOH��Һ��Ũ����ֵƫ�ߵ���________��
A����ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
B���ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и���
C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D����ʽ�ζ���δ�ñ�������ϴ��ֱ��ע�������
��4���ñ�����ζ���������NaOH��Һʱ���ж��ζ��յ�������ǣ�ֱ���������һ�����ᣬ_____________________________Ϊֹ��
��5��ijѧ������3��ʵ��ֱ��¼�й��������±���
�ζ����� | ����NaOH��Һ�����/mL | 0.1000mol/L��������/mL | ||
�ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
��һ�� | 25.00 | 0.00 | 26.28 | 26.28 |
�ڶ��� | 25.00 | 1.55 | 31.30 | 29.75 |
������ | 25.00 | 0.20 | 26.42 | 26.22 |
�����NaOH��Һ�����ʵ���Ũ�ȣ�c(NaOH)=__________mol/L��(������λ��Ч����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽����������Թ�ҵ�ϳɰ���Ӧ��Ӱ��[N2(g)+3H2(g)![]() 2NH3(g) ��H<0]�������ܱ������г���2mo1N2��4molH2ģ��ϳɰ���Ӧ���ڲ�ͬ�¶��£�ƽ����ϵ�а����������������ѹǿ(P)�Ĺ�ϵ��ͼ��ʾ(��ѹ=��ѹ�����ʵ�������)������˵������ȷ����
2NH3(g) ��H<0]�������ܱ������г���2mo1N2��4molH2ģ��ϳɰ���Ӧ���ڲ�ͬ�¶��£�ƽ����ϵ�а����������������ѹǿ(P)�Ĺ�ϵ��ͼ��ʾ(��ѹ=��ѹ�����ʵ�������)������˵������ȷ����
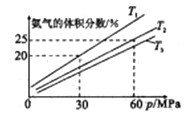
A. ������1mo1N��N����ͬʱ����3mo1N-H��,��˵���÷�Ӧ�ﵽƽ��״̬
B. ��T2��60MPaʱ,N2��ƽ���ѹΪ17.5MPa
C. ��T1��T2�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K3,��K1<K3
D. ��T1��30MPaʱ,������2Сʱ�ﵽƽ�⣬��:v(H2)=0.75mo1/(L��h)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȣ�ClO2����һ�����������������۵�Ϊ-59�棬�е�Ϊ11�棬Ũ�ȹ���ʱ�����ֽ⣬������ը��ij������ȤС��ͨ��������NaClO2��Һ��Ӧ����ȡ����ClO2��װ������ͼ��ʾ��
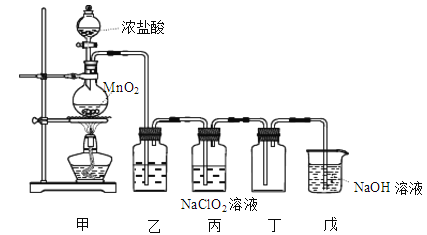
(1)��װ����Բ����ƿ�ڷ�����Ӧ�Ļ�ѧ����ʽ��______��
(2)��װ���з����ķ�Ӧ���ܾ�������ɣ��뽫�䲹����������______���û�ѧ����ʽ��ʾ������HClO + HCl + 2NaClO2 = 2ClO2��+ 2NaCl + H2O��
(3)Cl������ʱ���ClO2�����ɣ�������װ�ã����װ���ڲ���ClO2���������Լӿ졣ʵ������г���ͨ��������N2ϡ��ClO2����Ŀ����______��д��������Ư��Һ�Ļ�ѧ����ʽ����˫���ű�ʾ����ת�Ƶķ�������Ŀ______��
(4)��װ���ձ���NaOH��Һ����ClO2��������ClO-��ClO3-,�÷�Ӧ�����ӷ���ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ӧ��
��Cl2+FeI2=FeCl2+I2
��2Fe2++Br2=2Fe3++2Br��
��Co2O3+6HCl=2CoCl2+Cl2��+3H2O
����˵����ȷ���ǣ� ��
A. ��Ӧ�٢ڢ��е���������ֱ���I2��Fe3+��CoCl2
B. �������Ϸ���ʽ���Եõ������ԣ�Cl2>Fe3+>Co2O3
C. �ڷ�Ӧ���е�1 mol Co2O3�μӷ�Ӧʱ��2 mol HCl������
D. ���������õ�Cl2+FeBr2 =FeCl2+Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ط�Ӧ�����ӷ���ʽ��д��ȷ����
A. Al2O3�������ˮ��Al2O3��2NH3��H2O�T2AlO![]() ��2NH4����H2O
��2NH4����H2O
B. ����ˮ��Ӧ��2Na+2H+�T2Na++H2��
C. ����Ͷ�뵽NaOH��Һ�У�2Al+2OH-=2AlO![]() +H2��
+H2��
D. Na2CO3��Һ�еμ�������ϡ���H++ CO![]() �THCO
�THCO![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com