
【题目】为了探究外界条件对工业合成氨反应的影响[N2(g)+3H2(g)![]() 2NH3(g) △H<0],现往密闭容器中充入2mo1N2和4molH2模拟合成氨反应。在不同温度下,平衡体系中氨气的体积分数与总压强(P)的关系如图所示(分压=总压×物质的量分数)。下列说法中正确的是
2NH3(g) △H<0],现往密闭容器中充入2mo1N2和4molH2模拟合成氨反应。在不同温度下,平衡体系中氨气的体积分数与总压强(P)的关系如图所示(分压=总压×物质的量分数)。下列说法中正确的是
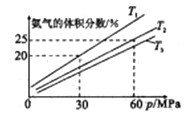
A. 若断裂1mo1N≡N键、同时断裂3mo1N-H键,则说明该反应达到平衡状态
B. 在T2、60MPa时,N2的平衡分压为17.5MPa
C. 若T1、T2温度下的平衡常数分别为K1、K3,刚K1<K3
D. 在T1、30MPa时,若经过2小时达到平衡,则:v(H2)=0.75mo1/(L·h)
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】某次实验需用480mL、0.5mol/L的稀H2SO4溶液,某同学用98%的浓H2SO4(ρ=1.84g/cm3)进行配制,请回答下列问题:
(1)实验需要的玻璃仪器除了烧杯、量筒、玻璃棒,还有_________________;
(2)计算:配制本次实验需要的稀硫酸需用量筒量取上述98%的浓H2SO4______ mL
(3)配制过程:①用量筒量取所需的浓硫酸
②将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
③用玻璃棒引流将烧杯中的溶液转移到已经检漏的合适规格的容量瓶中
④洗涤烧杯和玻璃棒2~3次,洗涤液也注入容量瓶中.轻轻摇动容量瓶,使溶液混合均匀
⑤向容量瓶中加入蒸馏水,在距离刻度1~2cm时,改用胶头滴管加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦将配制好的溶液转移至试剂瓶中待用。
上述配置溶液的步骤存在缺失,缺少的步骤是____________________。
(4)在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”).
①所用的浓硫酸长时间放置在密封不好的容器中_________;
②量取浓硫酸所用量筒有蒸馏水_________;
③定容时,俯视液面_________;
④用量筒量取浓硫酸时仰视液面___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体中不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:
KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)用双线桥表示该反应中电子转移的方向和数目,该反应中还原产物与氧化产物的物质的量之比是____,0.2mol KIO3参加反应时转移电子____mol。
(2)实验结束后分离I2和K2SO4溶液所用的试剂是_______。
A.CCl4 B.酒精 C.Na2SO4溶液 D.食盐水
所用的分离方法是______,所用主要玻璃仪器是_____________。
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4____mL,配制中需要用到的主要玻璃仪器是(填序号)______。
A.100mL量筒 B.托盘天平 C.玻璃棒 D.100mL容量瓶 E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是_______________
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二氮是一种白色固体,熔点30℃,升温时易液化和气化,并发生分解反应:N2O5(g) ![]() N2O3(g)+O2(g),N2O3(g)
N2O3(g)+O2(g),N2O3(g) ![]() N2O(g)+O2(g),在0.5L的密闭容器中,将2.5molN2O5加热气化,并按上式分解,当在某温度下达到化学平衡时,氧气的平衡浓度为4.4mol/L,N2O3的平衡浓度为1.6mol/L,则
N2O(g)+O2(g),在0.5L的密闭容器中,将2.5molN2O5加热气化,并按上式分解,当在某温度下达到化学平衡时,氧气的平衡浓度为4.4mol/L,N2O3的平衡浓度为1.6mol/L,则
(1) N2O5的分解率为______________________;
(2)N2O的平衡浓度______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_________________________________。
(2)该反应的正反应为____________反应(填“吸热”、“放热”)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______________℃。此温度下加入1molCO2(g)和1molH2(g),充分反应,达到平衡时,CO2的转化率为__________。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol/L ,c(H2)为1.5mol/L,c(CO)为1mol/L, c(H2O)为3mol/L,则正、逆反应速率的比较为υ正________υ逆 。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛。
(1)根据下图写出合成氨的热化学方程式是________________________。

(2)将1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___________(填“大于”、“等于”或“小于”)92.2 kJ,原因是______________;若加入催化剂,ΔH________(填“变大”、“不变”或“变小”)。
(3)已知分别破坏1 mol N≡N键、1 mol H-H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为________kJ。
(4)N2H4可视为NH3分子中的H被-NH2取代的产物。发射卫星时以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)==2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)==N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
则1 mol N2H4与NO2完全反应的热化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质。为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去)。下列说法正确的是

A.起始滤液常温下pH=7 B.试剂Ⅰ为Ba(NO3)2溶液
C.上图过程须经2次过滤 D.步骤③目的是除去CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Ba2+、C1—、SO42—、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
实验序号 | 实验内容 | 实验结果 |
a | 加AgNO3溶液 | 有白色沉淀生成 |
b | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
c | 加足量BaC12溶液,将所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
试回答下列问题:
(1)该混合物中一定不存在的离子是______________________。
(2)试写出实验b发生反应的离子方程式_______________________。
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol·L—1) |
___________ | ___________ |
___________ | ___________ |
(4)判断混合物中是否存在K+,如果不存在,请说明理由,如果存在,请求出C(K+)的取值范围?______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com