
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Ba2+、C1—、SO42—、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
实验序号 | 实验内容 | 实验结果 |
a | 加AgNO3溶液 | 有白色沉淀生成 |
b | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
c | 加足量BaC12溶液,将所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
试回答下列问题:
(1)该混合物中一定不存在的离子是______________________。
(2)试写出实验b发生反应的离子方程式_______________________。
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol·L—1) |
___________ | ___________ |
___________ | ___________ |
(4)判断混合物中是否存在K+,如果不存在,请说明理由,如果存在,请求出C(K+)的取值范围?______________。
【答案】Mg2+、Cu2+、Ba2+NH4++OH-![]() NH3↑+H2OSO42-0.1CO32-0.2存在,c(K+)≥0.1mol/L
NH3↑+H2OSO42-0.1CO32-0.2存在,c(K+)≥0.1mol/L
【解析】
该混合物溶于水后得到无色澄清的溶液,一定不含铜离子,加入硝酸银溶液有沉淀生成,说明溶液中可能存在氯离子、碳酸根离子和硫酸根离子中的一种或几种,1.12L气体为氨气,氨气的物质的量为0.05mol,溶液一定含有铵根离子,并且物质的量为0.05mol,2.33克沉淀为硫酸钡,物质的量为0.01mol,6.27克为硫酸钡和碳酸钡沉淀,碳酸钡的质量为6.27-2.33=3.94g,则碳酸钡的物质的量为0.02mol,故溶液中含有0.01mol硫酸根离子和0.02mol碳酸根离子。根据离子共存可知,溶液一定不存在镁离子和钡离子。(1) 根据以上分析可知,该混合物中一定不存在Mg2+、Cu2+、Ba2+; (2) 实验b发生的反应为NH4++OH- =NH3 ↑+ H2O;(3) 根据以上分析可知,溶液中含有0.01mol硫酸根离子,其物质的量浓度为0.01/0 .1=0.1mol/L,含有0.02mol碳酸根离子,其物质的量浓度为0.02/0.1=0.2mol/L; (4)根据分析溶液中含有铵根离子和碳酸根离子和硫酸根离子,其中正电荷为0.05mol,负电荷为0.01×2+0.02×2=0.06mol,所以一定还有阳离子存在,即一定有钾离子,因为不能确定是否含有氯离子,所以钾离子物质的量最小为0.01mol,其浓度最小为0.1mol/L。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】为了探究外界条件对工业合成氨反应的影响[N2(g)+3H2(g)![]() 2NH3(g) △H<0],现往密闭容器中充入2mo1N2和4molH2模拟合成氨反应。在不同温度下,平衡体系中氨气的体积分数与总压强(P)的关系如图所示(分压=总压×物质的量分数)。下列说法中正确的是
2NH3(g) △H<0],现往密闭容器中充入2mo1N2和4molH2模拟合成氨反应。在不同温度下,平衡体系中氨气的体积分数与总压强(P)的关系如图所示(分压=总压×物质的量分数)。下列说法中正确的是
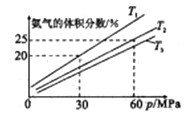
A. 若断裂1mo1N≡N键、同时断裂3mo1N-H键,则说明该反应达到平衡状态
B. 在T2、60MPa时,N2的平衡分压为17.5MPa
C. 若T1、T2温度下的平衡常数分别为K1、K3,刚K1<K3
D. 在T1、30MPa时,若经过2小时达到平衡,则:v(H2)=0.75mo1/(L·h)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
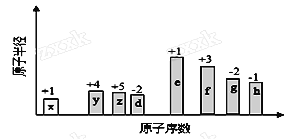
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关反应的离子方程式书写正确的是
A. Al2O3与过量氨水:Al2O3+2NH3·H2O═2AlO![]() +2NH4++H2O
+2NH4++H2O
B. 钠与水反应:2Na+2H+═2Na++H2↑
C. 铝粉投入到NaOH溶液中:2Al+2OH-=2AlO![]() +H2↑
+H2↑
D. Na2CO3溶液中滴加少量的稀盐酸:H++ CO![]() ═HCO
═HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L·min)]表示,则正确的关系式是
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L·min)]表示,则正确的关系式是
A. 4v(NH3)=5v(O2) B. 5v(O2)=6v(H2O) C. 2v(NH3)=3v(H2O) D. 4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
B. FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2=2Fe3++2H2O
C. 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D. 电解MgCl2水溶液的离子方程式:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“研究铁与水蒸气反应所得固体物质的成分、性质及再利用”实验探究,并回答下列问题:

探究一:设计如图所示装置进行“铁与水蒸气反应”的实验(夹持仪器略) 。
(1)硬质玻璃管 B 中发生反应的化学方程式为:________________________________。
(2)装置 D的作用是_______________________。
探究二:设计如下实验方案确定反应后硬质玻璃管B 中黑色固体的成分(已知酸性KMnO4溶液能与盐酸发生反应)。
(3)待硬质玻璃管 B 冷却后,取少许其中的固体物质继续进行如下实验:
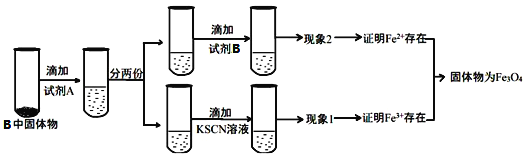
①试剂A是________,现象2为___________________ 。
②若现象1中溶液未变血红色,请从硬质玻璃管B中固体物质的成分分析可能的原因:________________________________________________________________________。
探究三:某学习小组设计用硬质玻璃管B中固体制备Fe3O4纳米材料的流程示意图如下:
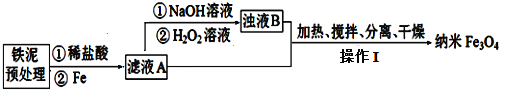
已知:①浊液B中铁元素以FeOOH形式存在;
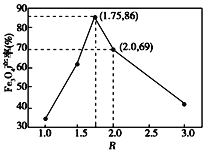
②在操作I中,相同条件下测得Fe3O4的产率与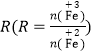 的关系如下图所示。
的关系如下图所示。
(4)在滤液A转化为浊液B反应完成后需再加热一段时间除去剩余H2O2,目的是_________。
(5)设浊液B中FeOOH的物质的量为amol,滤液A中的铁元素的物质的量为bmol。为使Fe3O4的产率最高,则![]() =_________。(填数值,保留3位有效数字)
=_________。(填数值,保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热 42g NaHCO3 和 Na2CO3 固体混合物,至没有气体放出时,剩余的固体质量是 35.8 g。那么原固体混合物中Na 2CO3 的质量是
A. 25.2g B. 16.8 g C. 10.6 g D. 24.8g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com