
【题目】某次实验需用480mL、0.5mol/L的稀H2SO4溶液,某同学用98%的浓H2SO4(ρ=1.84g/cm3)进行配制,请回答下列问题:
(1)实验需要的玻璃仪器除了烧杯、量筒、玻璃棒,还有_________________;
(2)计算:配制本次实验需要的稀硫酸需用量筒量取上述98%的浓H2SO4______ mL
(3)配制过程:①用量筒量取所需的浓硫酸
②将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
③用玻璃棒引流将烧杯中的溶液转移到已经检漏的合适规格的容量瓶中
④洗涤烧杯和玻璃棒2~3次,洗涤液也注入容量瓶中.轻轻摇动容量瓶,使溶液混合均匀
⑤向容量瓶中加入蒸馏水,在距离刻度1~2cm时,改用胶头滴管加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦将配制好的溶液转移至试剂瓶中待用。
上述配置溶液的步骤存在缺失,缺少的步骤是____________________。
(4)在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”).
①所用的浓硫酸长时间放置在密封不好的容器中_________;
②量取浓硫酸所用量筒有蒸馏水_________;
③定容时,俯视液面_________;
④用量筒量取浓硫酸时仰视液面___________。
【答案】胶头滴管 、500mL容量瓶 13.6 将烧杯中的溶液冷却至室温 偏低 偏低 偏高 偏高
【解析】
(1) 根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器。没有480mL的容量瓶,应选择大于480mL规格相近的容量瓶,故选择500mL的容量瓶;
(2) 根据c=![]() 计算浓硫酸的物质的量浓度;
计算浓硫酸的物质的量浓度;
(3)根据实验操作的步骤分析缺少的实验步骤;
(4)分析操作对溶质的物质的量,溶液体积的影响,根据c=![]() 分析操作对所配溶液浓度的影响。
分析操作对所配溶液浓度的影响。
(1)没有480mL容量瓶,因此需要配制500mL溶液,则实验需要的玻璃仪器除了烧杯、量简、玻璃棒,还需要胶头滴管、500mL容量瓶;
故答案为:胶头滴管 、500mL容量瓶;
(2)根据c=![]() 可知浓硫酸的浓度是
可知浓硫酸的浓度是![]() mol/L=18.4mol/L。由于稀释过程中溶质的物质的量不变,则需用量筒量取浓硫酸的体积为
mol/L=18.4mol/L。由于稀释过程中溶质的物质的量不变,则需用量筒量取浓硫酸的体积为![]() 13.6mol/L;
13.6mol/L;
(3)根据配制一定物质的量浓度的溶液步骤:计算、称量、溶解、冷却转移、洗涤转移、定容、摇匀。缺少的步骤是将烧杯中的溶液冷却至室温,
故答案为:将烧杯中的溶液冷却至室温;
(4)①所用的浓硫酸长时间放置在密封不好的容器中,浓硫酸吸水,浓度变稀,实际量取的浓硫酸中溶质硫酸的额物质的量偏小,所配溶液浓度偏低;
②量取浓硫酸所用量筒有蒸馏水,取浓硫酸的实际体积偏小,所配反应的浓度偏低;
③定容时,俯视液面,导致所配溶液的体积偏小,所配溶液的浓度偏高;
④用量筒量取浓硫酸时仰视液面,导致量取的浓硫酸的体积偏大,硫酸的物质的量偏大,配制的溶液浓度偏高;
故答案为:偏低;偏低;偏高;偏高。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
【题目】常温下,Ka(HCOOH)=1.77×104,Ka(CH3COOH)=1.75×105,Kb(NH3·H2O) =1.75×105,下列说法正确的是
A. 相同体积pH均为3的HCOOH和CH3COOH溶液,中和NaOH的能力相同
B. 0.2 mol·L-1 HCOOH与0.1 mol·L-1 NaOH 等体积混合后:c(HCOO) + c(OH) < c(HCOOH) + c(H+)
C. 浓度均为0.1 mol·L1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者
D. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是( )

A. ①②中Mg作为负极,③④中Fe作为负极
B. ②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作为负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作为正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。
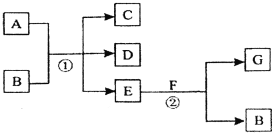
回答下列问题:
(1)A、G的化学式分别为________________、 ________________。
(2)F和E反应的化学方程式为____________________________。
(3)写出反应①的化学方程式____________________________________。
(4)在反应②中,每生成2.24 L气体G(标准状况)时,消耗F ___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) △H=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2 和1 mol O2;(乙) 1 mol SO2 和0.5 mol O2;(丙) 2 mol SO3;恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3(g) △H=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2 和1 mol O2;(乙) 1 mol SO2 和0.5 mol O2;(丙) 2 mol SO3;恒温、恒容下反应达平衡时,下列关系一定正确的是
A. 若c(SO2)与c(O2)之比为k,则:k甲=k丙>k乙
B. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
C. 容器内压强P:P甲=P丙>2P乙
D. SO3的质量m:m甲=m丙>2m乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知汽车尾气中的主要污染物为NOx、CO、超细颗粒(PM2.5)等有害物质。目前,已研究出了多种消除汽车尾气污染的方法。
(1)工业上可采用CO和H2合成甲醇,发生反应为(I)CO(g)+2H2(g)![]() CH3OH(g) △H<0 在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是_______。
CH3OH(g) △H<0 在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是_______。
A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
E.混合气体的密度减小 F.氢气的转化率减小
(2)在汽车上安装三元催化转化器可实现反应:(Ⅱ)2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0 。则该反应在________________(填高温、低温或任何温度)下能自发进行。
N2(g)+2CO2(g) △H<0 。则该反应在________________(填高温、低温或任何温度)下能自发进行。
(3)将NO和CO以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。以下说法正确的是_________
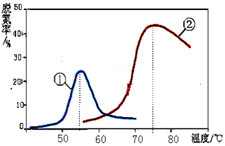
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.曲线①、②最高点表示此时平衡转化率最高
D.两种催化剂分别适宜于55℃和75℃左右脱氮
(4)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
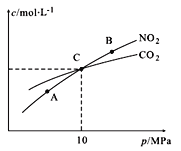
① A、B两点的浓度平衡常数关系:Kc(A)_______Kc(B)(填“<” 或“>”或“=”)。
② A、B、C三点中NO2的转化率最高的是____(填“A”或“B”或“C”)点。
③ 计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,回答下列问题:
(1)还原剂是________(填写化学式,下同),氧化剂是________
(2)氧化剂与氧化产物的物质的量之比是__________________。
(3)当有2 mol HNO3被还原时,反应中转移的电子数为________________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究外界条件对工业合成氨反应的影响[N2(g)+3H2(g)![]() 2NH3(g) △H<0],现往密闭容器中充入2mo1N2和4molH2模拟合成氨反应。在不同温度下,平衡体系中氨气的体积分数与总压强(P)的关系如图所示(分压=总压×物质的量分数)。下列说法中正确的是
2NH3(g) △H<0],现往密闭容器中充入2mo1N2和4molH2模拟合成氨反应。在不同温度下,平衡体系中氨气的体积分数与总压强(P)的关系如图所示(分压=总压×物质的量分数)。下列说法中正确的是
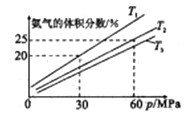
A. 若断裂1mo1N≡N键、同时断裂3mo1N-H键,则说明该反应达到平衡状态
B. 在T2、60MPa时,N2的平衡分压为17.5MPa
C. 若T1、T2温度下的平衡常数分别为K1、K3,刚K1<K3
D. 在T1、30MPa时,若经过2小时达到平衡,则:v(H2)=0.75mo1/(L·h)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com