
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为__________;
1 mol B2A4分子中含__________molσ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为__________,乙为_____________;高温时,甲易转化为乙的原因为__________________。
(15分)(1)1s22s22p63s23p63d104s1(2分)
(2)C<O<N(2分) 同一周期,随着原子序数的增加,元素的第一电离能呈现逐渐增大的趋势,但氮元素最外层电子达到半满的稳定构型,其第一电离能大于氧元素(2分)
(3)sp2杂化(2分) 5(2分)
(4)CuO(2分) Cu2O(2分)
Cu2O中Cu的d轨道为全充满状态,较稳定,所以高温时,CuO易转化为Cu2O(1分)
解析试题分析:A、B、C、D、E五种元素的原子序数依次增大,B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍,则B原子核外有6个电子,因此B为碳元素;D原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以D为氧元素;C原子序数介于碳元素与氧元素之间,则C为氮元素;原子序数A<B,B为碳元素,A原子的最外层电子数等于其周期序数,则A为氢元素;E+原子核外有3层电子且各层均处于全满状态,E为铜元素。即A为氢元素;B为碳元素;C为氮元素;D为氧元素;E为铜元素。
(1)E为铜元素,原子核外有29个电子,则根据工作原理可知,基态原子的电子排布式为1s22s22p63s23p63d104s1。
(2)B为碳元素,C为氮元素,D为氧元素,同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C。由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以B、C、D三种元素的第一电离能数值由小到大的顺序为C<O<N。
(4)根据晶胞的结构并依据均摊法可知,甲中氧原子的个数是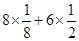 =4个,铜原子的个数是4个,则甲的化学式是CuO。同样可知乙中氧原子的个数是
=4个,铜原子的个数是4个,则甲的化学式是CuO。同样可知乙中氧原子的个数是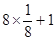 =2个,铜原子的个数是4个,则乙的化学式是Cu2O。由于Cu2O中Cu的d轨道为全充满状态,较稳定,所以高温时,CuO易转化为Cu2O。
=2个,铜原子的个数是4个,则乙的化学式是Cu2O。由于Cu2O中Cu的d轨道为全充满状态,较稳定,所以高温时,CuO易转化为Cu2O。
考点:考查核外电子排布、第一电离能比较、杂化轨道类型、共价键、晶体化学式以及物质稳定性判断


科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.乙烷和乙烯均可使酸性KMnO4溶液褪色 |
| B.纤维素、淀粉和蛋白质都是高分子化合物 |
| C.煤的干馏和石油的分馏均属化学变化 |
| D.酯类和糖类均能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
如图所示的无机物的转化关系中,部分生成物和反应条件已略去。其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子。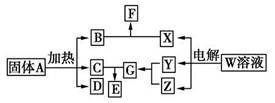
(1)写出X的电子式:________________ ;E中含有的化学键类型是________________。
(2)Z与C以物质的量之比3?1反应也能生成G,同时生成另一种二元化合物H,已知该反应中只有一种元素的化合价发生改变,则H的化学式为________________。H大量用于面粉的漂白和消毒,它与水反应的化学方程式为________________。
(3)将体积均为560 mL(标准状况)的B和Z同时缓缓通入水中,得到1.0 L溶液,则溶液中c(H+)=________mol/L。
(4)A~G七种物质中,属于电解质的有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满。B、E两元素组成化合物B2E的晶体为离子晶体。C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q。
(1)B的单质晶体为体心立方堆积模型,其配位数为 ;E元素的最高价氧化物分子的立体构型是 。F元素原子的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由 。
(3)A、G形成某种化合物的晶胞结构如图所示 。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
(4)在1.0l×105 Pa、t1℃时,气体摩尔体积为53.4 L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的组成为(写化学式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
A、B、C、D均是短周期元素,A和B同周期, B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2, A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同条件下反应,可生成D2A或D2A2。请回答
(1)写出元素符号A: ,B: ,C: 。
(2)D2A的电子式 ,BA2的结构式 。
(3)D2A2的化学式 ,灼烧这化合物火焰呈 色。
(4)C在元素周期表中的位置是 ,其原子结构示意图为 。
(5)比较A、B气态氢化物的沸点 ;原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
下表为元素周期表的一部分,请参照元素在表中的位置,回答下列问题(凡能用化学用语的必须用相应的化学用语回答):
(1)用原子符号表示中子数为8的编号为③的原子____,以上元素中原子的电子层数等于最外层电子数的元素为____,⑤、⑥、⑦、⑧三元素的简单离子半径由大到小的顺序为 。
(2)②①④三种元素能按原子个数比1:2:1形成一种在室内装修过程中常见的气体污染物。该气体分子的中心原子的杂化轨道类型为____,1mol该分子中π键的数目为____。
(3)写出⑥的单质在④的单质中燃烧产生的化合物的电子式 ,该化合物与足量⑨的低价硫酸盐溶液反应的离子方程式 。
(4)同主族元素的单质及化合物在许多性质上都存在着递变规律。下图是①、⑤、⑧、⑩的单质及①分别和⑤、⑧、⑩形成的化合物的键能大小。
由图中键能数据推断得知:①—R键(R表示⑤、⑧、⑩)的键能随分子中键长的增长而 (填“增大”或“减小”)。同主族元素随着原子序数的递增,非金属元素的单质分子中化学键的键长逐渐增大,键能____(填“一定减小”或“不一定减小”)根据图中键能数据,写出①的气态单质在⑧的气态单质中燃烧的热化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
14分)A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物, A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置是 ;
(2)检验C溶液中阳离子方法是(写出操作,现象及结论)
;
(3)写出反应①化学方程式: ;
(4)写出反应④离子方程式: ;
(5)写出反应⑥化学方程式: ;
(6)写出反应③阳极的电极反应式: ;
(7)从能量变化角度看,反应①②③中,属于△H<0的反应是 (填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(15分)丙烯可用于合成应用广泛的DAP树脂单体。下列反应流程中的反应条件和少量副产物省略。
已知: RCOOR’+R’’OH→RCOOR’’+R’OH(R、R’、R’’代表烃基) 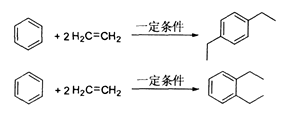
(1)DAP树脂单体的分子式为 。
(2)B中所含官能团的名称是 ,B→C的反应类型 。
(3)E的相对分子质量为162, 1H核磁共振有3个信号。写出E的结构简式 。
(4)请写出反应②的化学方程式 。
(5)D有多种同分异构体,请写出符合下列条件的同分异构体的结构简式 。
A.能与NaOH溶液反应
B.苯环上只有两个相同的取代基,且苯环上的一氯代物有两种
(6)以丙烯为原料,其他无机试剂任选,写出制备硝化甘油的合理流程图,注明试剂和
条件。注:合成路线的书写格式参照如下实例流程图:
CH3CHO CH3COOH
CH3COOH CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(17分)龙葵醛( )是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是工业上以苯为主要原料,生产龙葵醛的一种合成路线(部分反应条件及副产物已略去):
)是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是工业上以苯为主要原料,生产龙葵醛的一种合成路线(部分反应条件及副产物已略去):
请回答下列问题:
(1)已知:A的结构简式为 ,核磁共振氢谱中有 个峰。B有两种可能的结构,写出其中含有手性碳的B的结构简式: (手性碳用“*”标注)。
,核磁共振氢谱中有 个峰。B有两种可能的结构,写出其中含有手性碳的B的结构简式: (手性碳用“*”标注)。
(2)上述合成路线中,反应③的反应条件为 ;反应⑤的类型为 ;
(3)反应⑥的化学方程式为 。
(4)龙葵醛具有多种同分异构体,其中某些物质有下列特征:
a.其水溶液遇FeCl3溶液呈紫色;
b.苯环上只有两个取代基,且苯环上的一溴代物有两种;
c.分子中没有甲基。
写出符合上述条件的物质可能的结构简式: (只要求写一种)。
(5)三硝酸甘油酯是临床上常用的抗心律失常药,其结构简式: 。写出以1-丙醇为原料制备三硝酸甘油酯的合成路线流程图(无机试剂任用)。
。写出以1-丙醇为原料制备三硝酸甘油酯的合成路线流程图(无机试剂任用)。
已知:CH2=CHCH3+Cl2 CH2=CHCH2Cl+HCl
CH2=CHCH2Cl+HCl
合成路线流程图示例如下:CH3CH2OH CH2=CH2
CH2=CH2

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com