
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满。B、E两元素组成化合物B2E的晶体为离子晶体。C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q。
(1)B的单质晶体为体心立方堆积模型,其配位数为 ;E元素的最高价氧化物分子的立体构型是 。F元素原子的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由 。
(3)A、G形成某种化合物的晶胞结构如图所示 。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
(4)在1.0l×105 Pa、t1℃时,气体摩尔体积为53.4 L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的组成为(写化学式) 。
(共14分)(1)8(2分) 平面三角形(2分) 1s22s22p63s23p5(2分) [Cu(NH3)4]2+(2分)
(2)NaCl的熔点高于SiCl4,因为NaCl是离子晶体,SiCl4是分子晶体。(2分)
(3)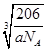 (2分) (4)Al2Cl6(2分)
(2分) (4)Al2Cl6(2分)
解析试题分析:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的,因此A是N。D、E原子核外的M层中均有两个未成对电子,则D的M层为3s2 3p2,是Si。E的M层为3s2 3p4,是S。B、E两元素组成化合物B2E的晶体为离子晶体,所以B为IA族的金属,B应该是钠元素。G原子核外最外层电子数与B相同,其余各层均充满,且G的原子序数最大,因此G是铜。C、F的原子均有三个能层,因此C、F在第三周期。C的逐级电离能前三个数据接近,第四电离能突变,所以易失去三个电子,为第ⅢA族元素,C是铝。C与F能形成原子数目比为1:3、熔点为190℃的化合物Q ,说明F为-1价,即F为Cl元素,Q是AlCl3。
(1)金属钠的单质晶体为体心立方堆积模型,其配位数为8;E元素的最高价氧化物分子是三氧化硫,其中心原子S原子含有的孤对电子对数=(6-3×2)÷2=0,所以三氧化硫分子的立体构型是平面三角形。根据构造原理可知,Cl元素原子的核外电子排布式是1s22s22p63s23p5;G的高价离子Cu2+与A的简单氢化物NH3形成的配离子的化学式为[Cu(NH3)4]2+。
(2)B、D分别与F形成的化合物分别是氯化钠和四氯化硅。因为NaCl是离子晶体,SiCl4是分子晶体,所以NaCl的熔点高于SiCl4。
(3)根据晶胞的结构可知,N原子在顶点,含有的个数=8×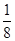 =1个。铜在棱边,含有的个数=12×
=1个。铜在棱边,含有的个数=12×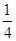 =3个,即化学式为Cu3N。设边长为x cm,则
=3个,即化学式为Cu3N。设边长为x cm,则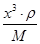 ×NA=1,解得x=
×NA=1,解得x=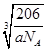 。
。
(4)根据M=ρ×Vm=5.00g/L×53.4L/mol=267,是AlCl3相对分子质量的267÷133.5=2倍,所以其化学式为Al2Cl6。
考点:考查元素周期表的结构以及元素原子的核外电子排布;配位健、晶体结构、晶体熔点判断以及晶体的有关计算等


科目:高中化学 来源: 题型:推断题
由中学化学常见元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转化关系,A是由地壳中含量最多的金属元素组成的。请回答:
(1)写出下列物质的化学式:乙_______、丁_______、戊_______
(2)写出甲物质在工业上的一种主要用途:_______
(3)写出甲→乙+丙反应的离子方程式:____________
A→乙+C反应的化学方程式______________
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
某铵态氮肥由W、X、Y、Z等4种短周期元素组成,其中W的原子半径最小。
I.若Y、Z同主族,ZY2是形成酸雨的主要物质之一。
(1)将X、Y、Z的元素符号填在右图所示元素周期表(局部)中的相应位置上。
(2)X的最髙价氧化物对应水化物的稀溶液与铜反应的化学方程式为___ ___。
(3)一定条件下,1mol XW3气体与O2完全反应生成X元素的单质和液态水,放出382.8 kJ热量。该反应的热化学方程式为________________________。
II.若Z是形成化合物种类最多的元素。
(4)该氮肥的名称是______(填一种)。
(5)HR是含Z元素的一元酸。室温时,用0.250mol?L—1NaOH溶液滴定25.0 mL HR溶液时,溶液的pH变化情况如图所示。其中,a点表示两种物质恰好完全反应。
①右图中x______7(填“>”、“<”或“=”)。
②室温时,HR的电离常数Ka=______(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如右图所示(部分产物已略去)。
(1)若A为金属单质,D是某强酸的稀溶液,则反应B+A→C的离子方程式为 。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则反应 A+D→B的离子方程式为 。
(3)若A为强碱,D为气态酸性氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如图a或图b所示(不考虑D的溶解和水的挥发)。
①若图a符合事实,则D为 (填化学式),此时图a中x 7(填“>”“<”或“=”)
②若图b符合事实,且图b中y<7,B的焰色反应为黄色,则B溶液中各离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
已知短周期的主族元素X、Y、Z、W、M的原子序数依次增大,X 是常见化肥的主要元素,Y 原子的最外层只有2个电子,Z单质可制成半导体材料,W元素形成的单质为黄色的固体。请回答以下问题:
(1)元素W在周期表的位置为 ;
(2)X与Y形成的化合物的电子式 ;
(3)Z的氧化物晶体类型为 ,12gZ的氧化物中含有的共价键数为 ;
(4)X、W形成的氢化物分别为甲和乙,且甲、乙所含的电子数相等,则甲的结构式为 ;
(5)W和M都是较活泼的非金属元素,用实验事实表明这两种元素的非金属性强弱 (用方程式书写或文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为__________;
1 mol B2A4分子中含__________molσ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为__________,乙为_____________;高温时,甲易转化为乙的原因为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(16分)下图中A、B、C、D、E、F、G均有机化合物。据图回答问题: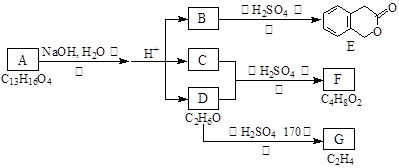
(1)D的化学名称是 。
(2)反应③的化学方程式是 。(有机物须用结构简式表示,下同)
(3)B的分子式是 ,A的结构简式是 。反应①的反应类型是 。
(4)符合下列3个条件的B的同分异构体的数目有多个。
i)含有邻二取代苯环结构、ii)与B有相同官能团、
iii)不与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式 。
(5)反应④的化学方程式是 。
G是重要的工业原料,用化学方程式表示G形成高聚物的反应
。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(16分)已知B是合成聚对苯二甲酸乙二醇酯(PET)的重要原料,有如下转化关系。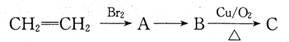
(1)B的官能团名称为 。
(2)A→B的反应方程式是 。
(3)向盛有1ml银氨溶液的洁净试管中滴入适量C,振荡后水浴加热可观察到的现象是 。
(4)工业合成PET过程如下:
① 的系统命名为 ,步骤Ⅲ的反应类型为 ;
的系统命名为 ,步骤Ⅲ的反应类型为 ;
②用步骤Ⅰ得到的信息完善下列方程式: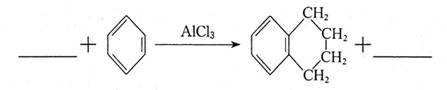
③实验室完成转化Ⅱ所需试剂为 ;
④写出满足下列条件的X的所有同分异构体 。
ⅰ分子中有苯环但无其它环状结构 ⅱ能在酸或碱溶液中水解 ⅲ1mol分子最多可与4molNaOH反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com