
【题目】一定温度下,在某密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g) ΔH>0,若15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
H2(g)+I2(g) ΔH>0,若15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
A.0~15 s内用I2表示的平均反应速率为v(I2)=0.002 mol·L-1·s-1
B.c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需的反应时间小于10 s
C.升高温度正反应速率加快,逆反应速率减慢
D.减小反应体系的体积,化学反应速率加快
【答案】D
【解析】
A. 015s内c(HI)由0.1molL1降到0.07molL1,v(HI)=![]() =0.002mol/(Ls),由速率之比等于化学计量数之比可知v(I2)=0.002mol/(Ls)×
=0.002mol/(Ls),由速率之比等于化学计量数之比可知v(I2)=0.002mol/(Ls)×![]() =0.001mol/(Ls),A项错误;
=0.001mol/(Ls),A项错误;
B. 若速率不变,c(HI)由0.07 molL1降到0.05 molL1所需的反应时间为![]() =10s,但随反应进行浓度减小,反应速率减小,则c(HI)由0.07 molL1降到0.05 molL1所需的反应时间大于10 s,B项错误;
=10s,但随反应进行浓度减小,反应速率减小,则c(HI)由0.07 molL1降到0.05 molL1所需的反应时间大于10 s,B项错误;
C. 升高温度,正逆反应速率均增大,且正反应速率大于逆反应速率,平衡正向移动,C项错误;
D. 减小反应体系的体积,压强增大,则化学反应速率加快,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.72g金属钠、氧化钠和过氧化钠的混合物与足量水反应,在标准状况下得到672mL混合气体,将混合气体电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比为( )
A. 3:2:1 B. 4:2:1 C. 2:1:1 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是

A. 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B. 图中b、c两点对应的NaHSO3反应速率相等
C. 图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1
D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 水的电离程度始终增大
B. c(NH4+)/c(NH3·H2O)先增大再减小
C. c(CH3COOH)与c(CH3COO-)之和始终保持不变
D. 当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(aNaHSO2bHCHOcH2O)在印染、医药以及原子能工业中应用广泛。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
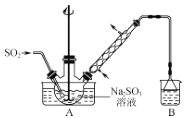
步骤1:在如图所示装置的烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤。
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B的烧杯中应加入的溶液是___。
(2)步骤2中加入锌粉时有NaHSO2和Zn(OH)2生成。
①写出加入锌粉时发生反应的化学方程式:___。
②生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是___。
(3)冷凝管中回流的主要物质除H2O外,还有___(填化学式)。
(4)步骤3中次硫酸氢钠甲醛不在敞口容器中蒸发浓缩的原因是___。
(5)步骤2抽滤所得滤渣的成分为Zn和Zn(OH)2,利用滤渣制备ZnO的实验步骤为:将滤渣置于烧杯中,___,900℃煅烧。(已知:Zn与铝类似,能与NaOH溶液反应;Zn2+开始沉淀的pH为5.9,沉淀完全的pH为8.9,pH>11时,Zn(OH)2能生成ZnO22-。实验中须使用的试剂有1.0molL-1NaOH溶液、1.0molL-1HCl溶液、水)
(6)产物组成测定实验:
准确称取1.5400g样品,溶于水配成l00mL溶液;取25.00mL样品溶液经AHMT分光光度法测得溶液吸光度A=0.4000(如图);另取25.00mL样品溶液,加入过量碘水后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到BaSO4固体0.5825g。

①样品溶液HCHO浓度为___molL-1。
②通过计算确定aNaHSO2·bHCHOcH2O的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com