
【题目】已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1.56×10-10。如图是向10 mL AgNO3溶液中逐渐加入0.1 mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]

A. 原AgNO3溶液的物质的量浓度为0.1 mol·L-1
B. 图中x点的坐标为(100,6)
C. 图中x点表示溶液中Ag+恰好完全沉淀
D. 把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图像在终点后变为虚线部分
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42-,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中Ca2+、Mg2+、SO42-。提纯的操作步骤和加入试剂的情况如图1:
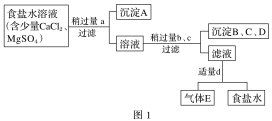
图中a、b、c、d分别表示上述4种试剂中的一种,试回答:
(1)生成沉淀A的化学方程式:_________。
(2)试剂d是_______;判断试剂d已经足量的简单方法为_______;如果在加入d试剂前没有过滤,引起的后果是________。
(3)沉淀B、C、D的化学式分别为(不讲顺序)________。
(4)现有如图2仪器,过滤出沉淀A、B、C、D时必须用到________(填序号)。
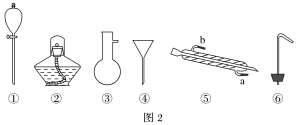
Ⅱ.海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的_______(填序号);实验时③中除加入适量海水外,还需加入_______,其作用是________。
Ⅲ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述中的仪器,该仪器名称________。为了使该仪器中液体可以顺利流下,应进行的具体操作是________。分液后提取碘单质的实验操作名称为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示A是固体金属单质,燃烧时火焰呈黄色。

(1)写出下列转化的化学方程式。
A→B________________;
B→C___________。
(2)列举下列物质的一种主要用途:
A_____________;
B_________________。
(3)在上述物质转化关系图中的化学反应里,没有元素化合价变化的是______(用“A→B”这样的形式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分(C、D中溶液成份均过量)。

(1)B装置的作用是______________________________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有__________气体产生,写出D中发生反应的离子方程式___________________________________。若去掉C,是否能得出同样结论并解释其原因__________________________。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解,平均分成2份;_____ | _________________________ | 固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为x mol,固体残留物Fe2O3的物质的量为y mol,D中沉淀物质的量为z mol,根据氧化还原反应的基本规律,x、y和z应满足的关系为___________。
(5)结合上述实验现象和相关数据的分析,完成硫酸亚铁铵[(NH4)2Fe(SO4)2]在500℃时隔绝空气加热完全分解的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1。已知a+b=12,请回答下列问题:
(1)该温度下水的离子积常数Kw=________________。
(2)该溶液中由水电离出的c(OH-)=_________________。
(3)该温度下,将NH3溶于水得100 mL 0.1 mol·L-1的氨水,测得pH=9,则该条件下,NH3· H2O的电离平衡常数Kb为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图。

(1)丁子香酚分子式为 。
(2)下列物质在一定条件下能跟丁子香酚反应的是 。
a.NaOH溶液 b.NaHCO3溶液 c.FeCl3溶液 d.Br2的CCl4溶液
(3)符合下述条件的丁子香酚的同分异构体共有____________种,写出其中任意任一种结构简式___________。
① 与NaHCO3溶液反应
② 苯环上只有两个取代基
③ 苯环上的一氯取代物只有两种
(4)丁子香酚的某种同分异构体A可发生如下转化(部分反应条件已略去)。
提示:RCH=CHR′![]() RCHO+R′CHO
RCHO+R′CHO

A→B的化学方程式为_______________________,反应类型为______________________。C中滴加少量溴水振荡,主要现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g) + 2O2(g) =2 NO2(g) ΔH = +67.7kJ/mol
2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
A. N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
B. 铂做电极,以KOH溶液为电解质的肼——空气燃料电池,放电时的负极反应式:N2H4 -4e- + 4OH- = N2 + 4H2O
C. 肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O![]() N2H5+ + OH-
N2H5+ + OH-
D. 2NO2![]() N2O4,加压时颜色加深,可以用勒夏特列原理解释
N2O4,加压时颜色加深,可以用勒夏特列原理解释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在环保、化工行业有一种溶液浓度的表示方法:质量—体积浓度,用单位体积溶液中所含的溶质质量来表示,单位g·m-3或g·L-1。现有一种20 ℃时的饱和CuSO4溶液,密度为1.2 g·cm-3,质量—体积浓度为200 g·L-1,则对此溶液的说法不正确的是( )
A. 该溶液的质量分数为16.7%
B. 该溶液的物质的量浓度为1.25 mol·L-1
C. 在20 ℃时,硫酸铜的溶解度为20 g
D. 在20 ℃时把200 g CuSO4·5H2O溶解于1 L水中恰好得到饱和溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com