
下列事实不能说明Cl原子的得电子能力比S原子强的是( )
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
| A.②⑤ | B.①② | C.①②④ | D.①③⑤ |
科目:高中化学 来源: 题型:单选题
X和Y两元素的阳离子具有相同的电子层结构。X元素的阳离子半径大于Y元素的阳离子半径。Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。则X、Y、Z三种元素原子序数的关系是
| A.X>Y>Z | B.Z>Y>X | C.Z>X>Y | D.Y>X>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关化学用语使用正确的是( )
A.硫原子的原子结构示意图: |
B.NH4Cl的电子式: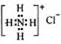 |
C.原子核内有10个中子的氧原子: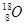 |
| D.纯碱的化学式为NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
元素X的最高正价和负价的绝对值之差为6,元素Y原子次外层与元素X原子次外层均为8个电子,X、Y的离子具有相同的电子排布,X、Y形成的化合物是( )
| A.MgF2 | B.MgCl2 | C.CaCl2 | D.CaBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
W、X、Y、Z是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Y元素形成的单质,常温下丙和己均为气体。已知反应:甲+乙 丁+己,甲+丙
丁+己,甲+丙 戊+己;常温下0.01 mol·L-1丁溶液的pH为12。下列说法正确的是
戊+己;常温下0.01 mol·L-1丁溶液的pH为12。下列说法正确的是
| A.元素X在周期表中的位置为第2周期ⅥA族 |
| B.元素X、Y、Z的原子半径由大到小的顺序为r(Z)>r(Y)>r(X) |
| C.1 mol甲与足量的乙完全反应转移的电子数为6.02×1023 |
| D.1.0 L0.1 mol·L-1戊溶液中阴离子的总物质的量小于0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于元素周期表的说法正确的是
| A.能生成碱的金属元素都在ⅠA族 |
| B.原子序数为14的元素位于元素周期表的第3周期ⅣA族 |
| C.稀有气体元素原子的最外层电子数均为8 |
| D.第二周期ⅣA族元素的原子核电荷数和中子数一定为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下表是部分短周期元素的原子半径及主要化合价,以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径 | 0.160 nm | 0.143 nm | 0.112 nm | 0.104 nm | 0.066 nm |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知X为第三周期元素的原子,该原子要达到8电子稳定结构,则需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是( )
| A.X元素最高价氧化物对应的水化物一定是强酸 |
| B.X元素的氢化物的化学式一定为H2X |
| C.X的单质一定是良好的半导体材料 |
| D.X元素的氧化物一定能与烧碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )。
| A.Li是最活泼金属,F是最活泼非金属 |
| B.Mg(OH)2碱性比Ca(OH)2强 |
| C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 |
D.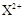 的核外电子数目为18,则X在第四周期第ⅡA族 的核外电子数目为18,则X在第四周期第ⅡA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com