
【题目】下列事实不能用勒夏特列原理解释的是
①由H2、I2蒸气、HI气体组成的平衡体系加压后颜色变深
②黄绿色的氯水光照后颜色变浅
③使用催化剂可加快SO2转化为SO3的速率
④在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
A.②③B.②④C.①③D.①④
【答案】C
【解析】
①该反应反应前后气体体积不变,所以压强不影响化学平衡的移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,所以不能用勒夏特列原理解释,①选;②氯水中的次氯酸受光照射会分解,次氯酸浓度减小,使得化学平衡Cl2+H2O![]() HCl+HClO向右移动,能用勒夏特列原理解释,②不选;③催化剂不影响平衡移动只能够加快化学反应速率,所以不能用勒夏特列原理解释,③选;④溶液中存在平衡Fe3++SCN-
HCl+HClO向右移动,能用勒夏特列原理解释,②不选;③催化剂不影响平衡移动只能够加快化学反应速率,所以不能用勒夏特列原理解释,③选;④溶液中存在平衡Fe3++SCN-![]() Fe(SCN)2+,加铁粉,铁与Fe3+反应,Fe3+浓度降低,则平衡向左移动进行,溶液颜色变浅或褪去,能用勒夏特利原理来解释,④不选;答案选C。
Fe(SCN)2+,加铁粉,铁与Fe3+反应,Fe3+浓度降低,则平衡向左移动进行,溶液颜色变浅或褪去,能用勒夏特利原理来解释,④不选;答案选C。
【点晴】
勒沙特列原理是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒沙特列原理适用的对象应存在可逆过程,若与可逆过程无关,则不能用勒沙特列原理解释,答题时注意灵活应用。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】有下列物质的溶液:①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)的大小比较为____________(用序号表示,下同)。
(2)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为___________,经测定溶液中c(CH3COO-)为1.4×10-3 mol/L,此温度下醋酸的电离常数Ka=____________,温度升高,Ka将_____(填“变大”“不变”或“变小”,下同),加入少量CH3COONa后c(H+)______,Ka______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用钛白渣[主要成分为FeSO4,还含有少量Fe2(SO4)3、MgSO4及TiOSO4]为主要原料生产氧化铁黄(FeOOH)的一种工艺流程如下:
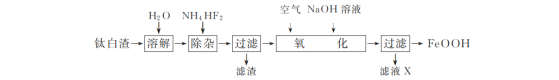
(1)“溶解”时,TiOSO4发生水解生成难溶于水的H2TiO3,反应的化学方程式为________。
(2)“除杂”时,加入NH4HF2固体的作用是________。
(3)“氧化”时,Fe2+生成FeOOH的离子方程式是________。
(4)滤液X中主要含有的阳离子是________(填化学式)。
(5)实验测得反应溶液的pH、温度对氧化铁黄产率的影响如图所示。
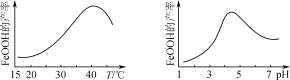
①反应温度宜选择________。
②氧化时应控制pH的合理范围是4.5左右,pH过小或过大均会导致氧化铁黄产率较低,其可能原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入:①适量HCl②适量NaCl③适量的氨水④适量的NaOH,正确的是
A. ①② B. ④ C. ③④ D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的盐酸;③pH=11的氨水;④pH=11的NaOH溶液。下列说法正确的是
A.①和②混合溶液中:c(H+)=3.0 mol·L-1
B.①和④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
C.②和③混合溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-)
D.四种溶液稀释100倍,溶液的pH:③>④>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烃在光照下与氯气反应,只生成一种一氯代物的有( )
①2-甲基丙烷 ②环戊烷 ③2,2-二甲基丁烷 ④2,2-二甲基丙烷。
A.①②B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β硝基苯乙烯是一种黄色针状晶体,熔点55~58 ℃,沸点250~260 ℃,不溶于水,易溶于乙酸、二氯甲烷等有机溶剂。制备原理如下:
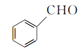 +CH3NO2
+CH3NO2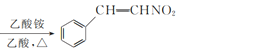
(1) 反应装置冷凝管中水应从________(填“a”或“b”)处通入。
(2)制备过程中,需在搅拌下滴加苯甲醛,控制滴加速率反应6 h,加热温度在110 ℃左右,那么采用的加热方法为________,如温度过高时,则可以采取________措施。
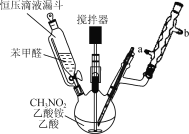
(3)反应混合液需加入一定量的水才析出黄色絮状物,加水的作用是________。
(4)过滤后用95%乙醇重结晶,再进行抽滤可获得黄色棱形晶体。抽滤装置所包含的仪器除减压系统外还有布氏漏斗和________(填仪器名称)。
(5)实验中使用恒压滴液漏斗的优点是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.3g乙醇和一定量的氧气混合点燃,恰好完全燃烧,放出热量为68.35kJ。
(1)该反应的热化学方程式为___。
(2)已知:
化学键 | Si-Cl | H-H | H-Cl | Si-Si |
键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。
工业上所用的高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热为___kJ·mol-1。
Si(s)+4HCl(g),该反应的反应热为___kJ·mol-1。
(3)已知水的比热容为4.2×10-3kJ·g-1·℃-1。8g硫黄在O2中完全燃烧生成气态SO2,放出的热量能使500g H2O的温度由18℃升至58℃,则硫黄燃烧热的热化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,有关制备途径及性质如下图所示。下列说法错误的是( )

A.途径①所用混酸中H2SO4与HNO3的最佳物质的量之比为3:2
B.与途径①、③相比,途径②更好地体现了绿色化学思想
C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量①=②<③
D.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com