
����Ŀ��Ŀǰ�������½��Ľ����Լ��80%���������������ij��������пұ�������ս����ȹ��������������ͼ��ʾ:

��֪:HCN�о綾����Ka(HCN)=5��10-10��
Au++2CN-=[Au(CN)2]-ƽ�ⳣ��KB=1��1038
��1��ĥ��ϸ�ȶԽ����ʵ�Ӱ����ͼ��ʾ�����ݽ�����Ӧѡ��ĥ��ϸ��_____Ϊ�ˡ�

��2������������ʯ�ҵ��ڿ���pH>11.5����Ŀ��֮һ����ֹ��Һ�е��軯��ת��ΪHCN���ӷ���������ԭ����________________(�����ӷ���ʽ��ʾ)��
��3�����軯�����ڣ�����NaCN��Һ��ȡ����pH�Ŀ��࣬���ڷ��ã���Auת��ΪNa[Au(CN)2]��
���仯ѧ����ʽΪ________________��
�� ���軯�������У�����ܽ�������80��ʱ�ﵽ���ֵ���������п��Ʒ�ӦҺ���¶���10-20����ԭ����:___________________________(��һ�㼴��)��
����֪2H++[Au(CN)2]-![]() Au++2HCN���÷�Ӧ��K=____________��
Au++2HCN���÷�Ӧ��K=____________��
��4����п��ԭNaAu(CN)2���ɽ����ĵ�п�����ɵĽ�����ʵ���֮��Ϊ____________��
��5���軯���о綾�������������Ϳ��Ի��������Ի����ĸ���Ӱ�졣H2O2������ˮ�е��軯��(��NaCN)�������·�Ӧʵ��:NaCN+H2O2+H2O=A+NH3����
��������A�Ļ�ѧʽΪ______________��
��ij��ˮ��H2O2����40min���ʣ������Ϊ0.16mg/L�������ʴ�80%������0-40minʱ��η�Ӧ����v(CN-)=____mg/(L��min)(���������λ��Ч����)��
���𰸡� 87% CN��+H2O![]() HCN+OH�� 4Au+8NaCN+O2+2H2O=4NaAu(CN)2+4NaOH ��������Һ�е��ܽ�������¶ȵ����߶��½����¶ȵ����ߣ��ٽ����軯���ˮ�⣬������HCN�Ļӷ��ٶ������¶ȵ����ߣ�Ca(OH)2���ܽ�ȷ����½������ּ����Һ������ 4��10-20 1:2 NaHCO3 0.016
HCN+OH�� 4Au+8NaCN+O2+2H2O=4NaAu(CN)2+4NaOH ��������Һ�е��ܽ�������¶ȵ����߶��½����¶ȵ����ߣ��ٽ����軯���ˮ�⣬������HCN�Ļӷ��ٶ������¶ȵ����ߣ�Ca(OH)2���ܽ�ȷ����½������ּ����Һ������ 4��10-20 1:2 NaHCO3 0.016
�������������������1������ͼʾ��ĥ��ϸ��Ϊ87%������Ʒλ�������2��������CN��ˮ������3�������軯�����ڣ� NaCN��Һ��ȡ����pH�Ŀ��࣬���ڷ��ã�������Au����ΪNa[Au(CN)2]�����¶ȵ����ߣ��ٽ����軯���ˮ�⣬������HCN�Ļӷ��ٶ����¶ȵ����ߣ�Ca(OH)2���ܽ�ȼ�С�����ּ����Һ����������2H++[Au(CN)2]-![]() Au++2HCN���÷�Ӧ��K=
Au++2HCN���÷�Ӧ��K=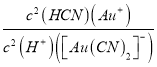 ����4�����ݵ�ʧ�����غ������п��ԭNaAu(CN)2���ɽ����ĵ�п�����ɵĽ�����ʵ���֮������5��������������ԭ��Ӧ���ɺ�Ԫ���غ����A�Ļ�ѧʽ��������v(CN-)=
����4�����ݵ�ʧ�����غ������п��ԭNaAu(CN)2���ɽ����ĵ�п�����ɵĽ�����ʵ���֮������5��������������ԭ��Ӧ���ɺ�Ԫ���غ����A�Ļ�ѧʽ��������v(CN-)=![]() ������
������
��������1������ͼʾ��ĥ��ϸ��ʱ������Ʒλ��������Խ�����Ӧѡ��ĥ��ϸ��87%Ϊ������2������ˮ�ⷽ��ʽ��CN��+H2O![]() HCN+OH������������CN��ˮ������3�����軯�����ڣ�����NaCN��Һ��ȡ����pH�Ŀ��࣬���ڷ��ã�������Au����ΪNa[Au(CN)2]���ٷ�Ӧ����ʽ��4Au+8NaCN+O2+2H2O=4NaAu(CN)2+4NaOH������������Һ�е��ܽ�������¶ȵ����߶��½����¶ȵ����ߣ��ٽ����軯���ˮ�⣬������HCN�Ļӷ��ٶ������¶ȵ����ߣ�Ca(OH)2���ܽ�ȷ����½������ּ����Һ�����������������п��Ʒ�ӦҺ���¶���10-20����Ka(HCN)=5��10-10����
HCN+OH������������CN��ˮ������3�����軯�����ڣ�����NaCN��Һ��ȡ����pH�Ŀ��࣬���ڷ��ã�������Au����ΪNa[Au(CN)2]���ٷ�Ӧ����ʽ��4Au+8NaCN+O2+2H2O=4NaAu(CN)2+4NaOH������������Һ�е��ܽ�������¶ȵ����߶��½����¶ȵ����ߣ��ٽ����軯���ˮ�⣬������HCN�Ļӷ��ٶ������¶ȵ����ߣ�Ca(OH)2���ܽ�ȷ����½������ּ����Һ�����������������п��Ʒ�ӦҺ���¶���10-20����Ka(HCN)=5��10-10����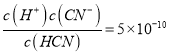 Au++2CN-=[Au(CN)2]-ƽ�ⳣ��KB=
Au++2CN-=[Au(CN)2]-ƽ�ⳣ��KB=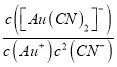 =1��1038�� 2H++[Au(CN)2]-
=1��1038�� 2H++[Au(CN)2]-![]() Au++2HCN��ƽ�ⳣ��K=
Au++2HCN��ƽ�ⳣ��K=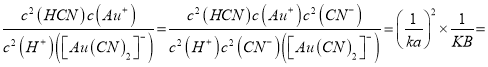 4��10-20 ����4����п��ԭNaAu(CN)2���ɽ�п���ϼ���0��Ϊ+2�ۣ��ϼ���+1��Ϊ0���������ĵ�п�����ɵĽ�����ʵ���֮��Ϊ1:2����5��������������ԭ��Ӧ���ɺ�Ԫ���غ���NaCN��H2O2��H2O ��Ӧ���ɰ�����̼����������A��NaHCO3����v(CN-)=
4��10-20 ����4����п��ԭNaAu(CN)2���ɽ�п���ϼ���0��Ϊ+2�ۣ��ϼ���+1��Ϊ0���������ĵ�п�����ɵĽ�����ʵ���֮��Ϊ1:2����5��������������ԭ��Ӧ���ɺ�Ԫ���غ���NaCN��H2O2��H2O ��Ӧ���ɰ�����̼����������A��NaHCO3����v(CN-)=![]() =
=![]() 0.016 mg/(L��min)��
0.016 mg/(L��min)��


 �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д� �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״����VL�����ܽ���1Lˮ�У�������Һ���ܶ�Ϊ�� g��mL��1����������Ϊ��������Ũ��Ϊc mol��L1�������й�ϵ����ȷ����( )
A. c=![]() B. ��=
B. ��=![]() C. ��=
C. ��=![]() D. ��=
D. ��=![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�ˮ�õ��Ĵ�ʳ��ˮ�г���Ca2+��Mg2+��SO42��![]() ����Ҫ�����ᴿ�����к�����CaCl2��MgSO4�Ĵ�ʳ��ˮ���ڳ�ȥ���������ɳ֮��Ҫ��4���Լ��������ᡢ��Na2CO3����NaOH����BaCl2����ȥʳ��ˮ�е�Ca2+��Mg2+��SO42��
����Ҫ�����ᴿ�����к�����CaCl2��MgSO4�Ĵ�ʳ��ˮ���ڳ�ȥ���������ɳ֮��Ҫ��4���Լ��������ᡢ��Na2CO3����NaOH����BaCl2����ȥʳ��ˮ�е�Ca2+��Mg2+��SO42��![]() ���ᴿʱ�IJ�������ͼ����Լ��������ͼ��
���ᴿʱ�IJ�������ͼ����Լ��������ͼ��

ͼ��a��b��c��d�ֱ��ʾ����4���Լ��е�һ�֣���ش�
��1������A��������________��
��2���Լ�d��________���ж��Լ�d�Ѿ������ķ�����____________________��
��3������b��c����Һ�з����Ļ�ѧ��Ӧ�Ļ�ѧ����ʽ��__________________________(��д����)��
��4�������������������˳�����A��B��Cʱ�����õ�����____(�����)�������۵�������______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��зḻ�ĵ⡣Ϊ�˴Ӻ�������ȡ�⣬ij�о���ѧϰС����Ʋ�����������ʵ�飨����һ�ֲ�����ˮ���ܶȱ�ˮС��Һ�壩��
����д���пհף�
��1����������պ���ʱ������Ҫ���ż��⣬����Ҫ�õ���ʵ��������_______��������������ѡ��������������ñ����ĸ��д�ڿհ״�����
A���ձ� B������ C�������� D�������� E���ƾ��� F��������
��2������۵�ʵ�����������_______�������Ŀ���ǴӺ��ⱽ��Һ�з�������ʵ�ͻ��ձ����ò����ʵ�����������_______��
��3�����������ȡ����Һ��ijѧ��ѡ���ñ�����ȡ���������_______���ڷ�Һ�����У�Ӧ�����Ȼ���ã����ֲ��________�����ţ��������ԡ�
A��ֱ�ӽ����ⱽ��Һ�ӷ�Һ©���Ͽڵ���
B��ֱ�ӽ����ⱽ��Һ�ӷ�Һ©���¿ڷų�
C���Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ����ⱽ��Һ���¿ڷų�
D���Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ����ⱽ��Һ���Ͽڵ���
��4�������һ�ּ�����ȡ����ˮ��Һ���Ƿ��е��ʵ�ļ�����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(C8H8)���Ϊ�й���ľ��塣��˸�̼ԭ�ӶԳƵ�������������İ˸����ϡ��������˵���������
A. �������ڿ����п�ȼ��ȼ���к��̲���
B. ������һ������1�֡����ȴ�����3�֡����ȴ���Ҳ��3��
C. �������DZ�(C6H6)��ͬϵ�Ҳ�DZ���ϩ(C6H5-CH=CH2)��ͬ���칹��
D. ��������������ȫ�ֽ����ֻ����������̼�͵���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ�����������������Ԫ�ء��ش���������:
��1����ԭ�ӵ�����ܲ������_______����۲���ӵĹ������ʽ(�����Ų�ͼ)Ϊ_______��
��2�� �Ƚϵڶ�������Cu______Zn(����>������=������<")��������_________��
��3������һ�������ﳣ���³���ɫ����ѧʽΪCrO5����֪���������и�Ϊ+6�ۣ���д��CrO5�Ľṹʽ___________��
��4��������ͭ����Ũ��ˮ���γ���ɫ������[Cu(NH3)2]+�������������ͭ�Ļ��ϼ�Ϊ________���ӻ�����Ϊ_________��[Cu(NH3)2]2SO4�������ӵ����幹����_________��
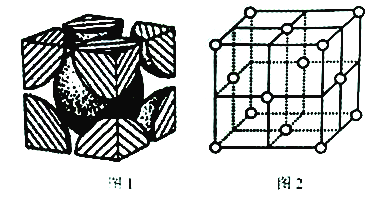
��5����֪ͼ1Ϊ���ľ����ṹͼ�������������______�ѻ�,������ʵ��ӵ�еĸ�ԭ����Ϊ_______��ͼ2��ͭ�ľ����ṹͼ������������������Ϊa nm,�þ�����ԭ�ӵ����ռ��������İٷ���Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ס��������ݻ���Ϊ1L�ĺ��������зֱ����2molA��2molB��1molA��1molB����ͬ�����·������·�Ӧ��A(g)+B(g) ![]() xC(g) ��H<0.�����������c(A)��ʱ��t�ı仯��ͼ��ʾ������˵��������ǣ�
xC(g) ��H<0.�����������c(A)��ʱ��t�ı仯��ͼ��ʾ������˵��������ǣ�

A. x���ܵ���2Ҳ���ܵ���3
B. ����ƽ��������������C�����ٴδﵽƽ��ʱA�����������С
C. �������������¶ȣ���ʹ�������и����ʵ������������������ͬ
D. �������������䣬ʹ�����������Ϊ2L����ƽ��ʱ�������У�0.25mol/L<c(A)<0.5mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�л���Mת��ΪX��Y��Z��W���ĸ���ͬ��Ӧ������������ȷ����
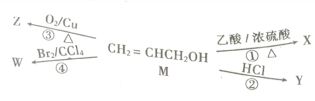
A. ��X��������ͬ��X��ͬ���칹����9��
B. ��Ӧ��һ�����ڼӳɷ�Ӧ
C. W�����к������ֹ�����
D. Z�ķ���ʽΪC3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��ͬѧ������ͼװ�öԵ���Ȼ�ͭʵ��������о���
װ�� | ���� |
| ���һ��ʱ��ʱ������ʯī����������壬����ʯī�ϸ��ź�ɫ���ʣ��ձ��ڱ��ȣ���Һ����ɫ��Ϊ��ɫ |
��1������Ϊ������������������_________����Һ���̵�ԭ��
��2���Ҳ������ϣ�CuCl2��Һ�д���ƽ�⣺Cu2+ + 4Cl-![]() [CuCl4]2-(��ɫ) ��H��0���ݴ�����Ϊ:�������У�[CuCl4]2-(��ɫ)Ũ��������CuCl2��ɫ��Һ��ϳ���ɫ��������ƽ���ƶ�ԭ���Ʋ��ڵ�������[CuCl4]2-Ũ�������ԭ��________________��
[CuCl4]2-(��ɫ) ��H��0���ݴ�����Ϊ:�������У�[CuCl4]2-(��ɫ)Ũ��������CuCl2��ɫ��Һ��ϳ���ɫ��������ƽ���ƶ�ԭ���Ʋ��ڵ�������[CuCl4]2-Ũ�������ԭ��________________��
��3����������ͼװ�ã�����ͬ�����µ��CuCl2��Һ������Һ��ɫ�������̽����
װ�� | ���� |
| �����ͬʱ��ʱ������ʯī����������ݣ���Һ��Ϊ��ɫ������ʯī�ϸ��ź�ɫ���ʣ���Һ����ɫ��Ϊ��ɫ��U�ܱ��ȣ���ȴ������������Һ��Ϊ��ɫ |
��ͨ�����������֤ʵ�˼��ҵĹ۵��������Һ���̵���Ҫԭ����������________�����ҵ�������________________��
��4���������������ϣ�
i. ���CuCl2��Һʱ���ܲ���[CuCl2]-��[CuCl2]-����Cu2+��ʻ�ɫ
ii. ϡ�ͺ�[CuCl2]-����Һ����CuCl��ɫ�����ݴ˱���Ϊ���������У�����[CuCl2]-����Cu2+��ʻ�ɫ����CuCl2��ɫ��Һ��ϳ���ɫ��
����������ʵ�飺
a��ȡ������ɫ��Һ2 mL����20 mLˮϡ�ͣ�����5���Ӻ���Һ�в�����ɫ������
b. ��ȡ�����Ȼ�ͭ�����ͭ�ۣ������м�2 mLŨ���ᣬ���Ȼ�ú�[CuCl2]-�Ļ�ɫ��Һ��
c. ��ȴ����������Һ����
d. ȡc��2 mL��Һ����20 mLˮϡ�ͣ�����5���Ӻ���Һ�в�����ɫ������
�� a��Ŀ����__________________��
�� д��b������[CuCl2]-�����ӷ���ʽ��____________________��
�� ����c�б�Ҫ�IJ���������____________________��
���ݴ˵ó����ۣ����ʱ������������[CuCl2]-�ǵ�����Һ���̵�ԭ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com