
����Ŀ���Ӻ�ˮ�õ��Ĵ�ʳ��ˮ�г���Ca2+��Mg2+��SO42��![]() ����Ҫ�����ᴿ�����к�����CaCl2��MgSO4�Ĵ�ʳ��ˮ���ڳ�ȥ���������ɳ֮��Ҫ��4���Լ��������ᡢ��Na2CO3����NaOH����BaCl2����ȥʳ��ˮ�е�Ca2+��Mg2+��SO42��
����Ҫ�����ᴿ�����к�����CaCl2��MgSO4�Ĵ�ʳ��ˮ���ڳ�ȥ���������ɳ֮��Ҫ��4���Լ��������ᡢ��Na2CO3����NaOH����BaCl2����ȥʳ��ˮ�е�Ca2+��Mg2+��SO42��![]() ���ᴿʱ�IJ�������ͼ����Լ��������ͼ��
���ᴿʱ�IJ�������ͼ����Լ��������ͼ��

ͼ��a��b��c��d�ֱ��ʾ����4���Լ��е�һ�֣���ش�
��1������A��������________��
��2���Լ�d��________���ж��Լ�d�Ѿ������ķ�����____________________��
��3������b��c����Һ�з����Ļ�ѧ��Ӧ�Ļ�ѧ����ʽ��__________________________(��д����)��
��4�������������������˳�����A��B��Cʱ�����õ�����____(�����)�������۵�������______��

���𰸡����ᱵ������Һ�в��ٲ�������CaCl2+Na2CO3===CaCO3��+2NaCl��BaCl2+Na2CO3===BaCO3��+2NaCl��MgCl2+2NaOH===Mg(OH)2��+2NaCl��Բ����ƿ
��������
Ҫ��ȥʳ����Һ�е���������Ca2+��Mg2+��![]() �������Լ��ǹ����ģ��μ�˳�������BaCl2��Na2CO3��NaOH��HCl(��BaCl2��NaOH��Na2CO3��HCl)���ؼ���Na2CO3��Һ������BaCl2��Һ�ĺ���μӣ��Գ�ȥ������BaCl2��ϡ������������μ��Գ�ȥ�������Լ�(��OH��
�������Լ��ǹ����ģ��μ�˳�������BaCl2��Na2CO3��NaOH��HCl(��BaCl2��NaOH��Na2CO3��HCl)���ؼ���Na2CO3��Һ������BaCl2��Һ�ĺ���μӣ��Գ�ȥ������BaCl2��ϡ������������μ��Գ�ȥ�������Լ�(��OH��![]() )����1�����������������Լ�aΪBaCl2������AΪ���ᱵ����2�������Թ�����b��c����Һ�к���NaCl��NaOH��Na2CO3��NaOH��Na2CO3�����ȥ��Ϊ���������ʣ����Լ�dΪ���ᣬ������������ķ�������Һ�в��ٲ�����������3��������������������b��c�����Ļ�ѧ����ʽΪ��CaCl2��Na2CO3=CaCO3����2NaCl��BaCl2��Na2CO3=BaCO3����2NaCl��MgCl2��2NaOH=Mg(OH)2����2NaCl����4������ʱʹ�õ���������Ȧ������̨����������©�����ձ�����ֽ�ȣ��ʢ���ȷ��������ΪԲ����ƿ��
)����1�����������������Լ�aΪBaCl2������AΪ���ᱵ����2�������Թ�����b��c����Һ�к���NaCl��NaOH��Na2CO3��NaOH��Na2CO3�����ȥ��Ϊ���������ʣ����Լ�dΪ���ᣬ������������ķ�������Һ�в��ٲ�����������3��������������������b��c�����Ļ�ѧ����ʽΪ��CaCl2��Na2CO3=CaCO3����2NaCl��BaCl2��Na2CO3=BaCO3����2NaCl��MgCl2��2NaOH=Mg(OH)2����2NaCl����4������ʱʹ�õ���������Ȧ������̨����������©�����ձ�����ֽ�ȣ��ʢ���ȷ��������ΪԲ����ƿ��


 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���ͬ�������ͬpH������ʹ�����Һ�ֱ��ˮϡ�ͣ�ƽ��pH����Һ����仯��������ͼ��ʾ����ͼ�ж���ȷ����
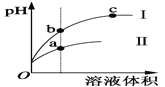
A. ��Ϊ����ϡ��ʱpH�仯����
B. b����Һ�ĵ����Ա�c����Һ�ĵ�������
C. a��KW��ֵ��c��KW��ֵ��
D. ����ͬŨ�ȵ�NaOH��Һ��ȫ�кͣ�����NaOH��Һ�������a���b���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ʋ�����Һ����Ҫԭ�ϣ���������ľ�����ܵı����ϡ�
��1����̬ͭԭ�ӵĵ����Ų�ʽΪ___________��
��2����ϩ���������Եõ���ϩ�棨CH2=CH-CN������ϩ���и�Ԫ�صĵ縺���ɴ�С˳��Ϊ____________,1mol��ϩ������к��Цм���ĿΪ_________��
��3��CN-��N2��Ϊ�ȵ����壬д��CN-�ĵ���ʽ______________��
��4��ͨ��X�������䷢�֣������д���SO42-���ӣ�SO42-���ӵ�VSEPR��������Ϊ___________��CO32-����ԭ�ӵ��ӻ���ʽΪ________��
��5������ͭ���տ�������һ�ֺ�ɫ���壬��ṹ��ͼ��ʾΪ����������������û�����Ļ�ѧʽ��______�����þ����о��������ͭԭ������ԭ��ֱ�Ӿ���Ϊacm�������ܶȱ���ʽΪ_____g/cm3��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ȼ�ѧ����ʽ��������ȷ����
A. ��֪2H2(g)+O2(g)=2H2O(g) ��H=-483.6kJ/mol����������ȼ����Ϊ241.8 kJ/mol
B. ��֪C(ʯī��s)=C(���ʯ��s) ��H>0������ʯ��ʯī�ȶ�
C. ��֪2C(s)+2O2(g)=2CO2(g) ��H1; 2C(s)+O2(g)=2CO(g) ��H2;������H1����H2
D. ��20.0gNaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7kJ����������÷�Ӧ�к��ȵ��ȷ���ʽΪNaOH(aq)+ HCl(aq)=NaCl(aq)+H2O(l) ��H��һ57.4kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.10 mol��L-1NaOH ��Һ�ֱ�ζ�20.00mL Ũ�Ⱦ�Ϊ0.10 mol��L-1CH3COOH��Һ��HCN��Һ���õζ���������ͼ������˵����ȷ����

A. ��ں͵����ʾ��Һ�ж��У�c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. ��ٺ͵����ʾ��Һ�У�c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
C. ��ۺ͵����ʾ��Һ�У�c(Na+)��c(OH-)��c(CH3COO-)��c(H+)
D. ��ٺ͵����ʾ��Һ�У�c(CH3COO-)��c(CN-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ����ģ�ҵ���ȡ���������(Na2S2O3)��̽�������ʡ�
��1����ȡ��������Ƶķ�Ӧװ�ü������Լ���ͼ��
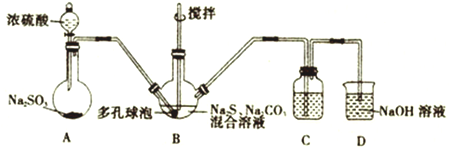
��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ__________________________����Һ©���Ļ���ʱ������Һ�岻��˳�����£����ܵ�ԭ����__________________________________��
��װ��B������Na2S2O3��ͬʱҲ����CO2����Ӧ�����ӷ���ʽΪ______________________________��
��װ��C��Ϊ�˼���װ��B��SO2������Ч�ʣ���C�е��Լ�Ϊ________________����B��SO2������Ч�ʵ�ʱ��C�е�����Ϊ________________________���������ʹ�ö�������⣬��д��һ�����B��SO2������Ч�ʵķ�����______________________________��
��2��Ԥ�Ⲣ̽����������Ƶ����ʣ���Ӧ������Һ�н��У���
Ԥ�� | ʵ����� | ʵ������ | |
̽��1 | Na2S2O3��Һ�ʼ��� | _________ | pH=8 |
̽��2 | Na2S2O3���л�ԭ�� | ��������ˮ�еμ�Na2S2O3 | ______ |
��̽��1�е�ʵ�����Ϊ________________________��
��̽��2�е�ʵ������Ϊ_____________________����Ӧ�����ӷ���ʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼ���رջ��������������ң������ͬ��������һ����H2��Cl2����ǡ��ʹ�������������ܶ���ͬ����������ȼʹH2��Cl2��ַ�Ӧ�����Ȼ�������:H2+Cl2=2HCl���ָ���ԭ�¶Ⱥ������ж���ȷ����

A. ��ʼʱ�������ҷ�������ͬ
B. ������������H2����
C. ��Ӧǰ��H2��ѹǿ��ͬ
D. �����������ܶ���ԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ�������½��Ľ����Լ��80%���������������ij��������пұ�������ս����ȹ��������������ͼ��ʾ:

��֪:HCN�о綾����Ka(HCN)=5��10-10��
Au++2CN-=[Au(CN)2]-ƽ�ⳣ��KB=1��1038
��1��ĥ��ϸ�ȶԽ����ʵ�Ӱ����ͼ��ʾ�����ݽ�����Ӧѡ��ĥ��ϸ��_____Ϊ�ˡ�

��2������������ʯ�ҵ��ڿ���pH>11.5����Ŀ��֮һ����ֹ��Һ�е��軯��ת��ΪHCN���ӷ���������ԭ����________________(�����ӷ���ʽ��ʾ)��
��3�����軯�����ڣ�����NaCN��Һ��ȡ����pH�Ŀ��࣬���ڷ��ã���Auת��ΪNa[Au(CN)2]��
���仯ѧ����ʽΪ________________��
�� ���軯�������У�����ܽ�������80��ʱ�ﵽ���ֵ���������п��Ʒ�ӦҺ���¶���10-20����ԭ����:___________________________(��һ�㼴��)��
����֪2H++[Au(CN)2]-![]() Au++2HCN���÷�Ӧ��K=____________��
Au++2HCN���÷�Ӧ��K=____________��
��4����п��ԭNaAu(CN)2���ɽ����ĵ�п�����ɵĽ�����ʵ���֮��Ϊ____________��
��5���軯���о綾�������������Ϳ��Ի��������Ի����ĸ���Ӱ�졣H2O2������ˮ�е��軯��(��NaCN)�������·�Ӧʵ��:NaCN+H2O2+H2O=A+NH3����
��������A�Ļ�ѧʽΪ______________��
��ij��ˮ��H2O2����40min���ʣ������Ϊ0.16mg/L�������ʴ�80%������0-40minʱ��η�Ӧ����v(CN-)=____mg/(L��min)(���������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��100��Cʱ��KW=1.0��10��12���ڸ��¶��£����0.1mol/LNa2A��ҺpH=6��
��H2A��ˮ��Һ�еĵ��뷽��ʽΪ_____��
��������pH=1��������H2A��Һ�ֱ���������Zn��Ӧ����������ȣ�H2A��Һ������H2____����ࡱ�����١���һ���ࡱ����
��2����0.4 mol/L HB��Һ��0.2 mol/L NaOH��Һ�������ϣ����Ի�Ϻ���Һ����ı仯������û����Һ��c��Na+����c��B������
�ٻ����Һ��c��B����_____c��HB����������������� ��=������
�ڻ����Һ��c��HB��+ c��B����_____0.2mol/L�����������������=������
��3����֪�ڳ����³�������ĵ���ƽ�ⳣ��Ka�����ʾ��
���� | CH3COOH | H2CO3 | HClO | HCN |
����ƽ�ⳣ��Ka | 1.75��10-5 | Ka1=4.4��10-7 Ka2=4.7��10-11 | 3.2��10-8 | 6.2��10-10 |
������������̼ͨ��NaClO��Һ�е����ӷ���ʽ_____��
��Ũ�Ⱦ�Ϊ0.01mol/L������4�����ʵ���Һ�ֱ��ˮϡ��100����pH�仯��С����_____�����ţ���
a��CH3COOH b��HCN c��HClO d��H2CO3
�۳�����Ũ����ͬ�Ĵ���ʹ����ƻ��ҺpH=6����c�� CH3COO������c�� CH3COOH��=___mol/L������ֵ�г�����ʽ���ɣ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com