
【题目】胆矾是配制波尔多液的主要原料,常用在树木,花卉的保护上。
(1)基态铜原子的电子排布式为___________。
(2)乙烯氨氧化可以得到丙烯腈(CH2=CH-CN),丙烯腈中各元素的电负性由大到小顺序为____________,1mol丙烯腈分子中含有π键数目为_________。
(3)CN-与N2互为等电子体,写出CN-的电子式______________。
(4)通过X射线衍射发现,胆矾中存在SO42-离子,SO42-离子的VSEPR构型名称为___________,CO32-中心原子的杂化形式为________。
(5)硫酸铜灼烧可以生成一种红色晶体,其结构如图所示为体心立方晶胞,则该化合物的化学式是______;若该晶体中距离最近的铜原子与氧原子直接距离为acm,则晶体密度表达式为_____g/cm3。

【答案】 1s22s22p63s23p63d104s1 N>C>H 3NA [:C┇┇N:]- 正四面体 sp2 Cu2O 
【解析】(1)铜的原子序数是29,基态铜原子的电子排布式为1s22s22p63s23p63d104s1。(2)非金属性越强,电负性越大,则丙烯腈中各元素的电负性由大到小顺序为N>C>H;双键中含有1个π键,三键中含有2个π键,则1mol丙烯腈分子中含有π键数目为3NA。(3)CN-与N2互为等电子体,互为等电子体的微粒结构相似,则CN-的电子式为![]() 。(4)SO42-离子中中心原子S原子含有的价层电子对数是4,则SO42-离子的VSEPR构型名称为正四面体;CO32-中中心原子碳原子的价层电子对数是
。(4)SO42-离子中中心原子S原子含有的价层电子对数是4,则SO42-离子的VSEPR构型名称为正四面体;CO32-中中心原子碳原子的价层电子对数是![]() ,不存在孤对电子,则碳原子的杂化形式为sp2。(5)晶胞中铜原子全部在晶胞内,共计4个,氧原子个数是1+8×1/8=2,所以该化合物的化学式是Cu2O;若该晶体中距离最近的铜原子与氧原子直接距离为acm,则体对角线是4a cm,边长是
,不存在孤对电子,则碳原子的杂化形式为sp2。(5)晶胞中铜原子全部在晶胞内,共计4个,氧原子个数是1+8×1/8=2,所以该化合物的化学式是Cu2O;若该晶体中距离最近的铜原子与氧原子直接距离为acm,则体对角线是4a cm,边长是![]() ,所以晶体密度表达式为
,所以晶体密度表达式为 。
。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R、N、T分别代表某种化学元素。请依据这9种元素回答下列问题。
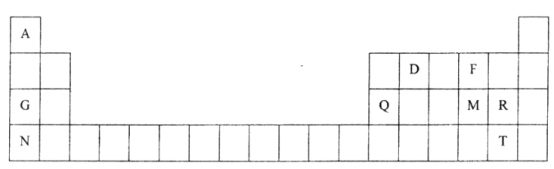
(1)以上9种元素中金属性最强的元素是_______(填元素符号)。
(2)元素的非金属性:M______R(填“>”或“<”)。
(3)R的最高价氧化物对应水化物的化学式是_____________。
(4)F、G两元素形成的淡黄色固体物质的电子式为_____________。
(5)表中M、R、N元素可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是_____________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中,所得溶液的密度为ρ g·mL-1,质量分数为ω,物质浓度为c mol·L1,则下列关系中正确的是( )
A. c=![]() B. ω=
B. ω=![]() C. ω=
C. ω=![]() D. ρ=
D. ρ=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1L1molL﹣1NaOH溶液吸收0.6molCO2 , 所得溶液中Na2CO3和NaHCO3的物质的量之比约为( )
A.2:3
B.1:2
C.2:1
D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)氯原子的结构示意图为_____________________。
(2)![]() 微粒中的质子数是_______,中子数是_______,核外电子数是_______。
微粒中的质子数是_______,中子数是_______,核外电子数是_______。
(3)49g硫酸的物质的量为________mol,其完全电离产生H+的个数为___________。
(4)V L Al2(SO4)3溶液中,含有a g Al3+,则溶液中Al3+的物质的量浓度_________;SO42— 物质的量浓度__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组通过下列反应原理制备SO2并进行性质探究。反应原理为:Na2SO3(固)+H2SO4(浓)= Na2SO4 + SO2↑+ H2O

(1)根据上述原理制备并收集干燥SO2的实验装置连接顺序为________________。(填接头序号)
(2)D中盛装的试剂为_________________。
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,其目的是检验SO2的_____________,可观察到的现象_________ 。
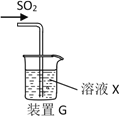
(4)实验1:乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4,为探究白色沉淀的成因,他继续进行如下实验验证:(已知:0.1mol/L Fe(NO3) 3的pH=2)
实验 | 操作 | 现象 | 结论和解释 |
2 | 将SO2通入0.1mol/L ____和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
3 | 将SO2通入_______ 和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3-能将H2SO3氧化为SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42—![]() ,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂:①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、Mg2+、SO42—
,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂:①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、Mg2+、SO42—![]() 。提纯时的操作步骤和加入试剂的情况如图。
。提纯时的操作步骤和加入试剂的情况如图。

图中a、b、c、d分别表示上述4种试剂中的一种,请回答:
(1)沉淀A的名称是________。
(2)试剂d是________;判断试剂d已经足量的方法是____________________。
(3)加入b、c后溶液中发生的化学反应的化学方程式有__________________________(任写两个)。
(4)现有下列仪器,过滤出沉淀A、B、C时必须用到的是____(填序号),仪器③的名称是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙两个容积均为1L的恒容容器中分别充入2molA、2molB和1molA、1molB。相同条件下发生如下反应:A(g)+B(g) ![]() xC(g) △H<0.测得两容器中c(A)随时间t的变化如图所示。下列说法错误的是:
xC(g) △H<0.测得两容器中c(A)随时间t的变化如图所示。下列说法错误的是:

A. x可能等于2也可能等于3
B. 若向平衡后的乙容器充入C,则再次达到平衡时A的体积分数减小
C. 若升高甲容器的温度,可使甲容器中各物质的体积分数与乙容器相同
D. 若其它条件不变,使乙容器体积变为2L,则平衡时乙容器中:0.25mol/L<c(A)<0.5mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com