
����Ŀ��ijͬѧ��50mL 0.50mol/L��������50mL 0.55mol/L��NaOH��Һ����ͼ1��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų������������к��ȣ� 

��1������˵������ȷ����
A.��ʵ��Ҳ���ڱ��±��н���
B.ͼ��ʵ��װ��ȱ�ٻ��β��������
C.�ձ���������ֽ���������DZ��¡����ȣ�����������ʧ
D.�������������Ϊ60mL������ʵ��������к��Ȳ����
��2����ͨ��ʵ��ⶨ�к��ȵġ�H�ľ���ֵ����С��57.3kJ/mol����ԭ�������
A.ʵ��װ�ñ��¡�����Ч����
B.�ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
C.��ȡNaOH��Һ�����ʱ���Ӷ���
D.���¶ȼƲⶨ�����ʼ�¶Ⱥ�ֱ�Ӳⶨ����������Һ���¶�
��3����һ������ϡ��ˮ��ϡ����������Һ��ϡ����������Һ�ֱ��1L 1molL��1��ϡ����ǡ����ȫ��Ӧ���䷴Ӧ�ȷֱ�Ϊ��H1����H2����H3 �� ���H1����H2����H3�Ĵ�С��ϵΪ
��4������V1mL1.0molL��1 HCl��Һ��V2mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ2��ʾ��ʵ����ʼ�ձ���V1+V2=50mL������ͼ2��֪���������Ƶ�Ũ��Ϊ��
���𰸡�
��1��D
��2��ABD
��3����H1����H2=��H3
��4��1.5mol/L
���������⣺��1��A����ʵ���ԭ���DzⷴӦǰ����¶ȣ��ɰܵĹؼ��DZ��£���С�ձ��������ֽƬ������ĭ�������ñ��±����棬��A��ȷ��B���������ȼƵĹ����֪��װ�õ�ȱ�������ǻ��β�������������B��ȷ��
C���к��Ȳⶨʵ��ɰܵĹؼ��DZ��¹�������С�ձ�֮��������ֽ���������Ǽ���ʵ������е�������ʧ����C��ȷ��
D����Ϊ�к�����ָ�������кͷ�Ӧ����1molH2O���ų��������������������أ��������������Ϊ60 mL������ʵ��������к�����ȣ���D����
��ѡD����2��A��ʵ��װ�ñ��¡�����Ч������²ⶨ������¶�ƫС���ⶨ���¶Ȳ�ƫС���ⶨ���ƫ�ͣ���A����
C����ȡNaOH��Һ�����ʱ���Ӷ�����������ȡ������������Һ�����ƫ���������������Ӧ���ɵ�ˮ�����ʵ���ƫ�ų�������ƫ�ߣ��ⶨ������¶�ƫ�ⶨ���ƫ�ߣ�������㣬��Ӱ��ⶨ�������C����
B���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ��У������в�������ɢʧ���ⶨ������¶�ƫС���¶Ȳ�ƫС���ⶨ���ƫ�ͣ���B��ȷ��
D�����¶ȼƲⶨ�����ʼ�¶Ⱥ�ֱ�Ӳⶨ����������Һ���¶ȣ������¶ȼ��ϵIJ�������������������Һ��Ӧ���ⶨ������������Һ�ij�ʼ�¶�ƫ�ߣ���������¶Ȳ�ƫ�ͣ��ⶨ���ƫ�ͣ���D��ȷ��
���Դ��ǣ�ABD����3��ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ����ЧӦ��H+��aq��+OH����aq���TH2O��H=��57.3kJ/mol����ʾϡ��Һ�����Ӻ�����������֮�䷴Ӧ����1molˮ�ų�������Ϊ57.3kJ���ֱ���1L 0.5molL��1��NaOH��Һ�м����������ơ�����������ǿ��ϡ��Һ����кͷ�Ӧ����ˮ����������ʣ������������������Ҫ���ȣ��������ԡ�H1����H2=��H3 �� ���Դ��ǣ���H1����H2=��H3����4��ǡ�÷�Ӧʱ�μӷ�Ӧ��������Һ�������30mL����V1+V2=50mL��֪�����ĵ�����������Һ������Ϊ20mL����ǡ�÷�Ӧʱ����������Һ�����ʵ����ʵ�����n����
HCl+ | NaOH | = | NaCl+ | H2O |
1 | 1 | |||
1.0molL��1��0.03L | n |
��n=1.0molL��1��0.03L=0.03mol������Ũ���ǣ� ![]() =1.5mol/L�����Դ��ǣ�1.5mol/L��
=1.5mol/L�����Դ��ǣ�1.5mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ��ӵ�����������ǣ� ��
A.��ɫ���壬����������ζ
B.������������ˮ
C.��¶�ڿ����гʷۺ�ɫ
D.�ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķе㰴�ɸߵ���˳��������ȷ���ǣ� �� �ٱ�����
�ڶ���
���Ҷ���
���Ҵ���
A.�٢ڢۢ�
B.�ܢۢڢ�
C.�ڢ٢ۢ�
D.�٢ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4molA�����3molB������2L�������л�ϲ���һ�������·������·�Ӧ��2A��g��+B��g��2C��g����
���� 2s���� C��Ũ��Ϊ 0.6molL��1 �� �������м���˵����
��������A ��ʾ��Ӧ��ƽ������Ϊ 0.3molL��1s��1
������ B�����������40%
��2s ʱ���� A ��ת����Ϊ30%
��2s ʱ���� B ��Ũ��Ϊ 1.0molL��1
������ȷ���ǣ� ��
A.�٢�
B.�ڢ�
C.�٢�
D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ʵ������ȡ���������ռ������漰���¼�����Ҫ�Σ�

��������2���Լ��� A������ʳ��ˮ B��NaOH��Һ
���������Լ���ѡ����գ�����A������B������
��д��������ȡ���������ӷ���ʽ_____________________��X��ҺӦѡ��______��
��β�����������У��������������______���գ�д���ù��̵����ӷ���ʽ_____��

��2��FeSO47H2O���ȷֽ�Ļ�ѧ����ʽΪ��2FeSO47H2O ![]() Fe2O3��SO2����SO3����14 H2O
Fe2O3��SO2����SO3����14 H2O
��ش�
�� FeSO47H2O������________�����������Ȳ��������尴ͼʾװ�ý���ʵ�飬֤ʵ����SO3��SO2�� ��˵��SO2���ڵ�ʵ��������________��Ϊ�ⶨBaSO4�����������������IJ�����������Ϊ________��ϴ�ӡ�������ء�
�����һ��ʵ�鷽�����û�ѧ������֤FeSO4���Ⱥ����ijɷ�(������������Ӧ)_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����ȡClO2�Ļ�ѧ��Ӧ��2NaClO3��SO2��H2SO4=2ClO2��2NaHSO4������˵����ȷ���ǣ� ��
A. SO2�ڷ�Ӧ��ʧȥ����B. NaClO3�ڷ�Ӧ�б�����
C. H2SO4�ڷ�Ӧ�еõ�����D. 1 mol�������ڷ�Ӧ��ʧȥ1mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
A. ��Ӧ�����κ�ˮ�����ʾ�������
B. �����ӷ���ʽ�������Ҫ��������ʽ��ʾ
C. ���ӷ�Ӧ����������Һ�з�Ӧ������Ũ�ȼ�С�ķ������
D. Al2(SO4)3��ˮ��Һ�еĵ��뷽��ʽ��Al2(SO4)3===Al3����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ˮ�г�����һ������Cr2O ![]() ��CrO
��CrO ![]() �����ǻ�����༰��̬ϵͳ�����ܴ���������д��������õĴ������������֣� ����1����ԭ������
�����ǻ�����༰��̬ϵͳ�����ܴ���������д��������õĴ������������֣� ����1����ԭ������
�÷��Ĺ�������Ϊ�ܢۢڢ�
CrO ![]()
![]() Cr2O72��
Cr2O72�� ![]() Cr3+
Cr3+ ![]() Cr��OH��3��
Cr��OH��3��
���еڢٲ�����ƽ�⣺2CrO42����ɫ��+2H+Cr2O72������ɫ��+H2O
��1����ƽ����ϵ��pH=2������Һ��ɫ��
��2����˵���ڢٲ���Ӧ��ƽ��״̬���� �� a��Cr2O ![]() ��CrO42��Ũ����ͬ
��CrO42��Ũ����ͬ
b.2v��Cr2O ![]() ��=v��CrO42��
��=v��CrO42��
c����Һ����ɫ����
��3���ڢڲ��У���ԭ1 mol Cr2O72�����ӣ���Ҫmol��FeSO47H2O��
��4���ڢ۲����ɵ�Cr��OH��3����Һ�д������³����ܽ�ƽ�⣺Cr��OH��3��s��Cr3+��aq��+3OH����aq��
�����£�Cr��OH��3���ܶȻ�Ksp=c��Cr3+��c3��OH����=10��32 �� Ҫʹc��Cr3+������10��5 mol/L����Һ��pHӦ���� ��
����2����ⷨ
�÷���Fe���缫��⺬ Cr2O72�������Է�ˮ�����ŵ����У�������������ҺpH���ߣ�����Cr��OH��3������
��5����Fe���缫��ԭ��Ϊ ��
��6��������������ҺpH���ߵ�ԭ���ǣ��õ缫��Ӧ���ͣ� �� ��Һ��ͬʱ���ɵij������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W���ֶ�����Ԫ�������ڱ��е�λ�ù�ϵ��ͼ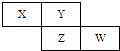
��1������ZԪ��ԭ�ӵ������������ǵ��Ӳ�����2����W�����ڱ��е�λ��Ϊ ��
��Y��ZԪ�ؿ���ɵĻ�����Ļ�ѧʽΪ ��
��д��ͭ��X�����������ˮ�����ϡ��Һ��Ӧ�����ӷ���ʽΪ ��
��W���������ˮ�����Ũ��Һ���ȶ������ȿɷֽ⣬����֮һ�ǻ���ɫ���壬�ҵ���28mol����ת��ʱ��������9mol���壬д���÷�Ӧ�Ļ�ѧ����ʽ ��
��2������Y��Z�ĺ��������֮��Ϊ22��Y����̬�⻯�����ʽΪ �� ��ҵ�ϳɸ����ʵĻ�ѧ����ʽΪ ��
�ڽ�X�����������ͨ�뵽��������Һ�У�ʵ�������� ��
��X������W�����������ˮ�����Ũ��Һ��Ӧ��������ת��0.4molʱ�����������������״���£��� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com