
【题目】(1)实验室制取、净化并收集氯气涉及以下几个主要阶段:

现有以下2种试剂: A.饱和食盐水 B.NaOH溶液
请在以上试剂中选择填空(填“A”或“B”):
①写出上述制取氯气的离子方程式_____________________,X溶液应选用______。
②尾气处理过程中,多余的氯气可用______吸收,写出该过程的离子方程式_____。

(2)FeSO47H2O受热分解的化学方程式为:2FeSO47H2O ![]() Fe2O3+SO2↑+SO3↑+14 H2O
Fe2O3+SO2↑+SO3↑+14 H2O
请回答:
① FeSO47H2O俗名叫________矾,将其受热产生的气体按图示装置进行实验,证实含有SO3和SO2。 能说明SO2存在的实验现象是________;为测定BaSO4沉淀的质量,后续的操作步骤依次为________、洗涤、干燥、称重。
②设计一个实验方案,用化学方法验证FeSO4受热后固体的成分(不考虑其他反应)_______________。
【答案】 MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O A B Cl2+2OH-=Cl-+ClO-+H2O 绿 品红溶液褪色 过滤 取适量固体,加足量的稀盐酸溶解,分成两份,一份中滴加KSCN溶液,若是血红色,则有Fe3+,说明含有Fe2O3 ;另外一份滴加BaCl2溶液,若有白色沉淀,则有SO42- ,说明含有未分解的FeSO4
Mn2++Cl2↑+2H2O A B Cl2+2OH-=Cl-+ClO-+H2O 绿 品红溶液褪色 过滤 取适量固体,加足量的稀盐酸溶解,分成两份,一份中滴加KSCN溶液,若是血红色,则有Fe3+,说明含有Fe2O3 ;另外一份滴加BaCl2溶液,若有白色沉淀,则有SO42- ,说明含有未分解的FeSO4
【解析】(1)由题意知,实验室制取、净化并收集氯气涉及以下几个主要阶段:首先用二氧化锰和浓盐酸加热制氯气,接着依次通过饱和食盐水和浓硫酸除去氯气中的杂质HCl和水蒸气,然后收集氯气,最后是尾气处理。 ①上述制取氯气的离子方程式为MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O,X溶液应选用饱和食盐水,选A。②尾气处理过程中,多余的氯气可用NaOH溶液吸收,选B ,该过程的离子方程式Cl2+2OH-=Cl-+ClO-+H2O。
Mn2++Cl2↑+2H2O,X溶液应选用饱和食盐水,选A。②尾气处理过程中,多余的氯气可用NaOH溶液吸收,选B ,该过程的离子方程式Cl2+2OH-=Cl-+ClO-+H2O。
(2)FeSO47H2O受热分解的化学方程式为:2FeSO47H2O ![]() Fe2O3+SO2↑+SO3↑+14 H2O。① FeSO47H2O俗名叫绿矾,将其受热产生的气体按图示装置进行实验,证实含有SO3和SO2。 能说明SO2存在的实验现象是品红溶液褪色;为测定BaSO4沉淀的质量,后续的操作步骤依次为过滤、洗涤、干燥、称重。
Fe2O3+SO2↑+SO3↑+14 H2O。① FeSO47H2O俗名叫绿矾,将其受热产生的气体按图示装置进行实验,证实含有SO3和SO2。 能说明SO2存在的实验现象是品红溶液褪色;为测定BaSO4沉淀的质量,后续的操作步骤依次为过滤、洗涤、干燥、称重。
②根据题中信息可知, FeSO4受热后所得固体中有氧化铁和可能未完全分解的FeSO4,可以设计如下实验验证其成分: 取适量固体,加足量的稀盐酸溶解,分成两份,一份中滴加KSCN溶液,若溶液变为血红色,则有Fe3+,说明含有Fe2O3 ;另外一份滴加BaCl2溶液,若有白色沉淀,则有SO42- ,说明含有未分解的FeSO4。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物.B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色.
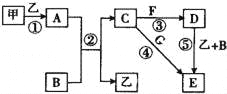
请回答下列问题:
(1)A是 .
(2)反应①~⑤中,属于氧化还原反应的是 填序号).
(3)反应⑤的化学方程式为 ;甲与B反应的离子方程式为 .
(4)在空气中将C溶液滴入F溶液中,观察到的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 ![]() 2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.
2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如图1所示. 
乙酸乙酯的实验室和工业制法常采用如图2装置:回答下列问题:
(1)写出A的电子式 .
(2)B、D分子中的官能团名称分别、 .
(3)写出下列反应的反应类型:①② , ④ .
(4)写出下列反应的化学方程式:①②④
(5)制取乙酸乙酯浓H2SO4的作用是:① , ② . 欲提高乙酸的转化率,可采取的措施有、等.
(6)碳酸钠溶液的作用是 , 导气管不能插入液面以下,原因是 . 加热前,大试管中加入几粒碎瓷片的作用是 .
(7)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解含有相同物质的量的Na2SO4和CuSO4的溶液。一段时间后,溶液颜色变浅。此时若要使溶液中的Na2SO4和CuSO4都恢复到电解前的浓度,应向电解后的溶液中加入适量的( )
A.Na2SO4和CuSO4
B.CuO
C.Na2O和CuO
D.H2O和CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.“液氯”因其具有强氧化性不能用钢瓶运输
B.氧化镁具有较高的熔点,常被用于耐高温材料
C.在医疗上,纯碱可用于治疗胃酸过多,但不能用于胃穿孔病人
D.硅是一种重要的半导体材料,常被用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热. 

(1)下列说法不正确的是
A.该实验也可在保温杯中进行
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失
D.若将盐酸体积改为60mL,两次实验所求得中和热不相等
(2)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(3)将一定量的稀氨水、稀氢氧化钠溶液、稀氢氧化钡溶液分别和1L 1molL﹣1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3 , 则△H1、△H2、△H3的大小关系为
(4)若将V1mL1.0molL﹣1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是
A. 用胆矾炼铜 B. 用铁矿石炼铁 C. 烧结粘土制陶瓷 D. 打磨磁石制指南针
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室进行NaCl溶液蒸发时,一般有以下操作过程:①放上蒸发皿②加热搅拌③放置酒精灯④固定铁圈的位置⑤停止加热、余热蒸干。其正确的操作顺序是( )
A. ①②③④⑤B. ③④①②⑤C. ②③①④⑤D. ②①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 
(1)若X极电极材料为铁,Y极电极材料为惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式是 .
②该装置的总反应方程式为
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 , Y电极的材料是 ,
②Y电极的电极反应式 . (说明:杂质发生的电极反应不必写出)
(3)若X极材料为光滑的铁钉(已经处理),Y极的材料为锌,电解质溶液a为ZnCl2 , ①X极的电极反应式为
②Y极的电极反应式为
③电解质溶液a的浓度将(填“增大”、“减少”、“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com