
【题目】中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是
A. 用胆矾炼铜 B. 用铁矿石炼铁 C. 烧结粘土制陶瓷 D. 打磨磁石制指南针
科目:高中化学 来源: 题型:
【题目】由氯化钾、氯化钙和盐酸组成的混合溶液,其c (K+)=0.2 mol·L-1,c(Ca2+)=0.4mol·L-1,c(Cl-)=1.2mol·L-1,则c(H+)为
A. 0.15mol·L-1 B. 0.2mol·L-1 C. 0.3mol·L-1 D. 0.4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室制取、净化并收集氯气涉及以下几个主要阶段:

现有以下2种试剂: A.饱和食盐水 B.NaOH溶液
请在以上试剂中选择填空(填“A”或“B”):
①写出上述制取氯气的离子方程式_____________________,X溶液应选用______。
②尾气处理过程中,多余的氯气可用______吸收,写出该过程的离子方程式_____。

(2)FeSO47H2O受热分解的化学方程式为:2FeSO47H2O ![]() Fe2O3+SO2↑+SO3↑+14 H2O
Fe2O3+SO2↑+SO3↑+14 H2O
请回答:
① FeSO47H2O俗名叫________矾,将其受热产生的气体按图示装置进行实验,证实含有SO3和SO2。 能说明SO2存在的实验现象是________;为测定BaSO4沉淀的质量,后续的操作步骤依次为________、洗涤、干燥、称重。
②设计一个实验方案,用化学方法验证FeSO4受热后固体的成分(不考虑其他反应)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料.
(1)制取氢气
已知:CH4(g)+H2O(g)CO(g)+3H2(g)△H=+206.2kJmol﹣1
CH4(g)+CO2(g)2CO(g)+2H2(g)△H=+247.4kJmol﹣1
(i)请写出CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式
(ii)若将0.1mol CH4和0.1mol H2O(g)通入体积为10L的密闭容器里,在一定条件下发生反应:
CH4(g)+H2O(g)CO(g)+3H2(g),CH4的平衡转化率与温度、压强的关系如图
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率
②该反应的化学平衡常数;
③图中的p1p2(填“<”、“>”或“=”);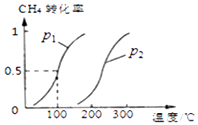
(2)制备甲醇
在压强为0.1MPa条件下,将a mol CO与3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)CH3OH(g)△H<0.若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度
B.再充入1mol CO和3mol H2
C.将CH3OH(g)从体系中分离
D.充入He,使体系总压强增大
E.使用更高效的催化剂
(3)合成乙酸
甲烷直接合成乙酸具有重要的理论意义和应用价值.光催化反应技术使用CH4和(填化学式)直接合成乙酸,且符合“绿色化学”的要求(原子利用率100%).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 与碱反应生成盐和水的物质均属于酸
B. 在离子方程式中盐类均要以离子形式表示
C. 离子反应总是向着溶液中反应物离子浓度减小的方向进行
D. Al2(SO4)3在水溶液中的电离方程式是Al2(SO4)3===Al3++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知浓度的硫酸溶液20mL,在加入0.2 mol·L-1 Ba(NO3)2溶液15 mL后,改加NaOH溶液,结果用去0.1mol·L-1 NaOH溶液100 mL恰好完全中和,则硫酸的物质的量浓度是
A. 0.5 mol·L-1 B. 1.0 mol·L-1 C. 0.2 mol·L-1 D. 0.25 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4—、C2O42—,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
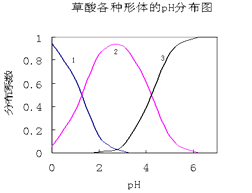
(1)图中曲线1表示________________的分布系数变化。
(2)现有物质的量浓度均为0.1mol/L的下列溶液:
a. Na2C2O4 b. NaHC2O4 c. H2C2O4 d. (NH4)2C2O4 e. NH4HC2O4
已知NaHC2O4溶液显酸性。
①NH4HC2O4显_____性(填“酸”、“碱”或“中”)
②Na2C2O4溶液中,![]() ____2 (填“>”、“=”、“<”), 原因是______________________________________________(用离子方程式表示)。
____2 (填“>”、“=”、“<”), 原因是______________________________________________(用离子方程式表示)。
③常温下,向10 mL 0. 1 mol/L H2C2O4溶液中滴加0.1 mol/L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,溶液显_______性(填“酸”、“碱”或“中”),且V(NaOH)______10 mL(填“>”、“=”或“<”)。
④五种溶液中c(H2C2O4)由大到小排列的顺序是 ________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在2L密闭容器中进行1分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
A.NO:0.001 molL﹣1
B.H2O:0.002 molL﹣1
C.NH3:0.002 molL﹣1
D.O2:0.0025 molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com