
����Ŀ������㷺��������Ȼ����������ú�����֮�У������ʵ�����ȼ�ϣ����������������Ʒ����Ҫԭ�ϣ�
��1����ȡ����
��֪��CH4��g��+H2O��g��CO��g��+3H2��g����H=+206.2kJmol��1
CH4��g��+CO2��g��2CO��g��+2H2��g����H=+247.4kJmol��1
��i����д��CH4��g����H2O��g����Ӧ����CO2��g����H2��g�����Ȼ�ѧ����ʽ
��ii������0.1mol CH4��0.1mol H2O��g��ͨ�����Ϊ10L���ܱ��������һ�������·�����Ӧ��
CH4��g��+H2O��g��CO��g��+3H2��g����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����
�ڸ÷�Ӧ�Ļ�ѧƽ�ⳣ����
��ͼ�е�p1p2�����������������=������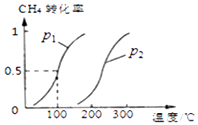
��2���Ʊ��״�
��ѹǿΪ0.1MPa�����£���a mol CO��3amol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״���CO��g��+2H2��g��CH3OH��g����H��0���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���
A.�����¶�
B.�ٳ���1mol CO��3mol H2
C.��CH3OH��g������ϵ�з���
D.����He��ʹ��ϵ��ѹǿ����
E.ʹ�ø���Ч�Ĵ���
��3���ϳ�����
����ֱ�Ӻϳ����������Ҫ�����������Ӧ�ü�ֵ�������Ӧ����ʹ��CH4�����ѧʽ��ֱ�Ӻϳ����ᣬ�ҷ��ϡ���ɫ��ѧ����Ҫ��ԭ��������100%����
���𰸡�
��1��CH4��g��+2H2O��g���TCO2��g��+4H2��g����H=+165.0kmol��1��0.003mol/��L��min����6.75��10��4��mol/L��2����
��2��BC
��3��CO2
���������⣺��1����i����CH4��g��+H2O��g���TCO��g��+3H2��g����H=206.2kmol��1��CH4��g��+CO2��g���T2CO��g��+2H2��g����H=247.4kJmol��1
�ɸ�˹���ɣ��١�2���ڵã�CH4��g��+2H2O��g���TCO2��g��+4H2��g����H=+165.0kmol��1 ��
���Դ��ǣ�CH4��g��+2H2O��g���TCO2��g��+4H2��g����H=+165.0kmol��1����ii����1.0mol CH4��2.0mol H2O �� g ��ͨ���ݻ��̶�Ϊ10L�ķ�Ӧ�ң���һ�������·�����ӦI����ͼ���֪100�����ת����Ϊ50%���ʲμӷ�Ӧ�ļ���Ϊ1mol��50%=0.5mol����
CH4 ��g��+ | H2O ��g�� | = | CO ��g��+ | 3H2 ��g�� | |
��ʼ����mol���� | 1.0 | 2.0 | 0 | 0 | |
�仯����mol���� | 0.5 | 0.5 | 0.5 | 1.5 | |
ƽ������mol���� | 0.5 | 1.5 | 0.5 | 1.5 |
�ټ���100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ�÷�Ӧ��ƽ����Ӧ����= ![]() =0.003 molL��1min��1 ��
=0.003 molL��1min��1 ��
���Դ��ǣ�0.0030molL��1min��1�� �ڸ÷�Ӧ�Ļ�ѧƽ�ⳣ��K= ![]() =
= 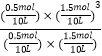 =6.75��10��4��mol/L��2 �� ���Դ��ǣ�6.75��10��4��mol/L��2����ͨ��ͼ����֪���¶���ͬʱ��p2��p1ʱ�������ת������ߣ�ƽ���������ƶ�������Ϊ����ϵ������ķ�Ӧ�����ݼ�Сѹǿƽ����ϵ������ķ����ƶ���֪��p1��p2 �� ���Դ��ǣ�������2��A���÷�Ӧ�Ƿ��ȵģ������¶ȣ�ƽ��������У����С�״����ʣ���A����
=6.75��10��4��mol/L��2 �� ���Դ��ǣ�6.75��10��4��mol/L��2����ͨ��ͼ����֪���¶���ͬʱ��p2��p1ʱ�������ת������ߣ�ƽ���������ƶ�������Ϊ����ϵ������ķ�Ӧ�����ݼ�Сѹǿƽ����ϵ������ķ����ƶ���֪��p1��p2 �� ���Դ��ǣ�������2��A���÷�Ӧ�Ƿ��ȵģ������¶ȣ�ƽ��������У����С�״����ʣ���A����
B���ٳ���1mol CO��3molH2 �� ����ѹǿ��ƽ�����ƣ�������״��IJ��ʣ���B��ȷ��
C����CH3OH��g������ϵ�з��룬���ʹƽ�������ƶ�����״��IJ��ʣ���C��ȷ��
D������He��ʹ��ϵ��ѹǿ����������䣬�����Ũ�Ȳ��䣬����ƽ�ⲻ���ƶ�������ı�״����ʣ���D����
E��ʹ�ô����ܸı䷴Ӧ���ʣ���ƽ�ⲻ�ƶ�����E����
��ѡBC����3�����üӳɷ�Ӧ����ʹԭ��������100%�����м��飨CH4������һ�ֻ�������ӳɷ�Ӧ����CH3COOH������ԭ���غ��֪��һ����ΪCO2 �� ���Դ��ǣ�CO2 ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����X��A12O3��Fe2O3��Cu��SiO2�е�һ�ֻ���������ɡ�
I.��������ʵ�飺

��ش�
��1������õ���ɫ��Һ���ù�����һ�������Ļ�ѧ��Ӧ�ǣ������ӷ���ʽ��ʾ��______��
��2����ӦII�Ļ�ѧ����ʽ��______________ ��X��һ�����е�������________��
II.Ϊ��һ��ȷ�����������X�ijɷ֣���ȡ9.4gX��������ʵ�顣

��3���������˲������ȱ��ϴ�Ӳ��裬��ʹ�òⶨ�Ĺ���������_______����ƫ��ƫС����Ӱ�죩
��4�������������ɫ��Һ��������Ϊ___________________��5��ԭ�������SiO2��������___________X��һ�������е�������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A��̼���⡢������Ԫ����ɣ���ȡ2.3g A��2.8L��������״�������ܱ�������ȼ�գ�ȼ�պ����ɶ�����̼��һ����̼��ˮ���������跴Ӧ��û��ʣ�ࣩ������Ӧ���ɵ���������ͨ��Ũ����ͼ�ʯ�ң�Ũ��������2.7g����ʯ������2.2g���ش��������⣺
��1��2.3g A��������ԭ�ӡ�̼ԭ�ӵ����ʵ������Ƕ��٣�
��2��ͨ������ȷ�����л���ķ���ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.��Һ�����������ǿ�����Բ����ø�ƿ����
B.����þ���нϸߵ��۵㣬�����������²���
C.��ҽ���ϣ��������������θ����࣬����������θ���ײ���
D.����һ����Ҫ�İ뵼����ϣ���������������ά
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ2A��g��+B��g��2C��g���ڷ�Ӧ������C��������WC���¶ȱ仯��ͼ��ʾ����ȷ���� 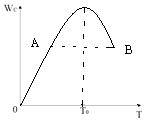
��1��T0��Ӧ��V����V���ϵ��V��V���������������������=������
��2��A��B��������Ӧ���ʵĴ�С��ϵVAVB�������������������=������
��3���¶�T��T0ʱ��Wc�������ԭ����
��4��500�������£��÷�Ӧ K=2.33�����ijʱ�̣�A��g����B��g����C��g����Ũ�Ⱦ�Ϊ0.5mol/L�����ʱv������v���棩���������������=����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��������Ź�Բ��õķ���ʷ�����з������첻�漰��ѧ��Ӧ����
A. �õ�����ͭ B. ������ʯ���� C. �ս�ճ�����մ� D. ��ĥ��ʯ��ָ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ͬ��ͬѹ�£���ͬ��Ŀ�ķ��ӱؾ�����ͬ�����
B. ͬ��ͬѹ�£��������N2��CO�ĵ��������
C. ��ͬ��������������ȣ������������ķ�����һ������
D. �κ������£�������������ʵ���֮�ȵ���ѹǿ֮��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯����ʵ�����г��õķ����Լ���Ҳ������ҽ�ƺ�����ҵ����ҵ������м��ԭ���Ʊ�NaI������Ҫ��������ͼ����ش��������⣺

��1����д����мת��ΪFe(OH)3�����ӷ�Ӧ����ʽ��______________________________________��
��2���жϵ��Ƿ�����ȫ��Ӧ��ʵ�鷽����______________________________________________��
��3�������NaI��Ʒ�����������������н�������Ŀ����__________________________________��
��4���ⶨ��Ʒ��NaI�����ķ����ǣ�______________
a����ȡ3.000 g��Ʒ���ܽ⣬��250 mL����ƿ�ж��ݣ�
b����ȡ25.00 mL������Һ����ƿ�У�
c����0.1000 mol/LAgNO3��Һ�ζ����յ㣬����AgNO3��Һ�����ƽ��ֵΪ19.00 mL��
�������ⶨ�������������У���Ҫ����Ƿ�©Һ��������______________________________��
��������Ʒ��NaI����������Ϊ__________________________��
��5����֪Ksp(AgI)=1.5��10-16����AgNO3��NaI����Һ��ϣ�������Һ��AgNO3��Ũ��Ϊ0.01 mol/L����ʼ����AgI����ʱ�����Һ��c( I- )=____________mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��һ�ֳ���������F��һ�ֺ��ɫ�������Ը���ͼ��ת����ϵ���ش��������⡣
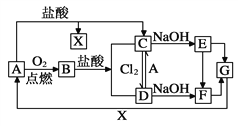
��1��д��A��C��F��G�Ļ�ѧʽ:A________��C_________��F_________��G_________��
��2������D�������ӵķ���_____________________________________________��
��3������C��ҺʱΪʲôҪ�ӹ���A_____________________________________��
��4��д������ת�������ӷ���ʽC��D��____________________________________����Eת��ΪF�������� _________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com