
【题目】碘化钠是实验室中常用的分析试剂,也常用于医疗和照相业。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题:

(1)试写出铁屑转化为Fe(OH)3的离子反应方程式:______________________________________。
(2)判断碘是否已完全反应的实验方法是______________________________________________。
(3)分离出NaI样品需在低温无氧环境中进行,其目的是__________________________________。
(4)测定产品中NaI含量的方法是:______________
a.称取3.000 g样品、溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用0.1000 mol/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为19.00 mL。
①上述测定过程所需仪器中,需要检查是否漏液的仪器有______________________________。
②上述样品中NaI的质量分数为__________________________。
(5)已知Ksp(AgI)=1.5×10-16,将AgNO3和NaI的溶液混合,假设混合液中AgNO3的浓度为0.01 mol/L,则开始生成AgI沉淀时,混合液中c( I- )=____________mol·L-1。
【答案】 2Fe+IO3-+3H2O=2Fe(OH)3+I- 取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应;反之,则未完全反应 防止NaI被氧化 250 mL容量瓶 酸式滴定管 95.00% 1.5×10-14
【解析】由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,过滤后得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI。
(1). 碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,反应的离子方程式为:2Fe+IO3-+3H2O=2Fe(OH)3+I-,故答案为:2Fe+IO3-+3H2O=2Fe(OH)3+I-;
(2). 淀粉遇碘变蓝,反应后加淀粉溶液无现象即可说明碘已反应完全,则判断反应中碘是否反应完全的方法为:取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应;反之,则未完全反应,故答案为:取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应;反之,则未完全反应;
(3). NaI具有还原性,易被空气中的氧气氧化,所以分离出NaI样品需在低温无氧环境中进行,以防止NaI被氧化,故答案为:防止NaI被氧化;
(4). ①. 配制溶液需用250mL容量瓶,硝酸银溶液为强酸弱碱盐,溶液呈酸性,滴定时需用酸式滴定管,容量瓶和酸式滴定管都应检查是否漏液,故答案为:250 mL容量瓶、酸式滴定管;
②. n(NaI)=n(AgNO3)=0.1mol/L×0.019L=0.0019mol,则3g样品中含有n(NaI)=0.019mol,m(NaI)=0.019mol×150g/mol=2.85g,所以NaI的质量分数为: ![]() ×100%=95.00%,故答案为:95.00%;
×100%=95.00%,故答案为:95.00%;
(5). 已知Ksp(AgI)=1.5×1016,将AgNO3和NaI的溶液混合,假设混合溶液中AgNO3的浓度为0.01molL1,Ksp(AgI)=c(Ag+)×c(I)=1.5×1016,则开始生成AgI沉淀时,混合溶液中c( I)=![]() mol/L=1.5×10-14,故答案为:1.5×10-14。
mol/L=1.5×10-14,故答案为:1.5×10-14。


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K+、Na+、CH3COO﹣、Br﹣
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO ![]() 、Cl﹣
、Cl﹣
C.0.1 molL﹣1 FeCl3溶液:K+、NH![]() 、I﹣、SCN﹣
、I﹣、SCN﹣
D.由水电离的c (H+)=1×10﹣14 molL﹣1的溶液中:Ca2+、K+、Cl﹣、HCO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料.
(1)制取氢气
已知:CH4(g)+H2O(g)CO(g)+3H2(g)△H=+206.2kJmol﹣1
CH4(g)+CO2(g)2CO(g)+2H2(g)△H=+247.4kJmol﹣1
(i)请写出CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式
(ii)若将0.1mol CH4和0.1mol H2O(g)通入体积为10L的密闭容器里,在一定条件下发生反应:
CH4(g)+H2O(g)CO(g)+3H2(g),CH4的平衡转化率与温度、压强的关系如图
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率
②该反应的化学平衡常数;
③图中的p1p2(填“<”、“>”或“=”);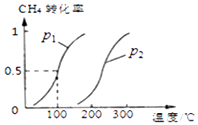
(2)制备甲醇
在压强为0.1MPa条件下,将a mol CO与3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)CH3OH(g)△H<0.若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度
B.再充入1mol CO和3mol H2
C.将CH3OH(g)从体系中分离
D.充入He,使体系总压强增大
E.使用更高效的催化剂
(3)合成乙酸
甲烷直接合成乙酸具有重要的理论意义和应用价值.光催化反应技术使用CH4和(填化学式)直接合成乙酸,且符合“绿色化学”的要求(原子利用率100%).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知浓度的硫酸溶液20mL,在加入0.2 mol·L-1 Ba(NO3)2溶液15 mL后,改加NaOH溶液,结果用去0.1mol·L-1 NaOH溶液100 mL恰好完全中和,则硫酸的物质的量浓度是
A. 0.5 mol·L-1 B. 1.0 mol·L-1 C. 0.2 mol·L-1 D. 0.25 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中存在Mg2+、Ag+、Ba2+三种离子,现用①NaOH②Na2CO3③NaCl将它们逐一沉淀并加以分离,加入试剂的顺序正确的是( )
A. ②③①B. ③①②C. ①③②D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4—、C2O42—,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
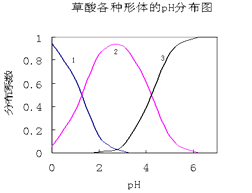
(1)图中曲线1表示________________的分布系数变化。
(2)现有物质的量浓度均为0.1mol/L的下列溶液:
a. Na2C2O4 b. NaHC2O4 c. H2C2O4 d. (NH4)2C2O4 e. NH4HC2O4
已知NaHC2O4溶液显酸性。
①NH4HC2O4显_____性(填“酸”、“碱”或“中”)
②Na2C2O4溶液中,![]() ____2 (填“>”、“=”、“<”), 原因是______________________________________________(用离子方程式表示)。
____2 (填“>”、“=”、“<”), 原因是______________________________________________(用离子方程式表示)。
③常温下,向10 mL 0. 1 mol/L H2C2O4溶液中滴加0.1 mol/L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,溶液显_______性(填“酸”、“碱”或“中”),且V(NaOH)______10 mL(填“>”、“=”或“<”)。
④五种溶液中c(H2C2O4)由大到小排列的顺序是 ________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种工业原料。工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
A.若管道漏气遇氨会产生白烟
B.该反应利用了氯气的强氧化性
C.该反应属于复分解反应
D.生成1 mol N2有6 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)坩埚是实验室用于灼烧或熔融固体物质的常用仪器,熔融烧碱,可以使用_______。
(2)写出铜与浓硫酸反应的化学方程式:____________________________。
(3)漂白粉的有效成分是 ____________________ 。
(4)玻璃中含有SiO2,所以可以用______________来刻蚀玻璃。
(5)钠常常保存在___________________中。
(6)酸雨有很大的危害,能直接破坏农作物,森林,草原等,请用化学方程式写出SO2形成硫酸型酸雨的过程:________________________ ,________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaOH溶液时,可造成所配溶液浓度偏高的是( )
A. 所用NaOH已吸潮 B. 摇匀后液面低于刻度线,不再补加水
C. 有少量NaOH溶液残留在烧杯内 D. 向容量瓶加水至时刻度线时俯视液面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com