
【题目】已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 ![]() 2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.
2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如图1所示. 
乙酸乙酯的实验室和工业制法常采用如图2装置:回答下列问题:
(1)写出A的电子式 .
(2)B、D分子中的官能团名称分别、 .
(3)写出下列反应的反应类型:①② , ④ .
(4)写出下列反应的化学方程式:①②④
(5)制取乙酸乙酯浓H2SO4的作用是:① , ② . 欲提高乙酸的转化率,可采取的措施有、等.
(6)碳酸钠溶液的作用是 , 导气管不能插入液面以下,原因是 . 加热前,大试管中加入几粒碎瓷片的作用是 .
(7)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是 .
【答案】
(1)![]()
(2)羟基;羧基
(3)加成反应;氧化反应;酯化反应或取代反应
(4)CH2=CH2+H2O ![]() CH3CH2OH;2 CH3CH2OH+O2
CH3CH2OH;2 CH3CH2OH+O2 ![]() 2 CH3CHO+2H2O;CH3COOH+CH3CH2OH
2 CH3CHO+2H2O;CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
(5)吸水剂;催化剂;增大乙醇的浓度;移去生成物
(6)吸收乙醇、中和乙酸、降低乙酸乙酯溶解度;防倒吸;防暴沸
(7)CH2BrCH2Br
【解析】解:A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2 , 与水发生加成反应得到B为CH3CH2OH,B能氧化得到C为CH3CHO,C氧化得到D为CH3COOH,乙醇与乙酸发生酯化反应得到CH3COOC2H5 , (1)由上述分析可知,A的结构简式为CH2=CH2 , 电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(2)B为为CH3CH2OH,含有官能团为羟基,D为CH3COOH,官能团名称是羧基,所以答案是:羟基;羧基;(3)通过以上分析知,①②④分别是加成反应、氧化反应、酯化反应或取代反应,所以答案是:加成反应;氧化反应;酯化反应或取代反应;(4)反应①的化学方程式为:CH2=CH2+H2O
;(2)B为为CH3CH2OH,含有官能团为羟基,D为CH3COOH,官能团名称是羧基,所以答案是:羟基;羧基;(3)通过以上分析知,①②④分别是加成反应、氧化反应、酯化反应或取代反应,所以答案是:加成反应;氧化反应;酯化反应或取代反应;(4)反应①的化学方程式为:CH2=CH2+H2O ![]() CH3CH2OH;
CH3CH2OH;
反应②的化学方程式为:2 CH3CH2OH+O2 ![]() 2 CH3CHO+2H2O;
2 CH3CHO+2H2O;
反应④的化学方程式为:CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,
所以答案是:CH2=CH2+H2O ![]() CH3CH2OH;
CH3CH2OH;
2 CH3CH2OH+O2 ![]() 2 CH3CHO+2H2O;
2 CH3CHO+2H2O;
CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O;(5)乙酸乙酯制取中浓硫酸能吸收生成的水,同时加快化学反应速率而作催化剂,欲提高乙酸的转化率,可以增大乙醇浓度、移去生成物,
CH3COOCH2CH3+H2O;(5)乙酸乙酯制取中浓硫酸能吸收生成的水,同时加快化学反应速率而作催化剂,欲提高乙酸的转化率,可以增大乙醇浓度、移去生成物,
所以答案是:吸水剂;催化剂;增大乙醇的浓度;移去生成物;(6)碳酸钠能吸收乙醇、中和乙酸、降低乙酸乙酯的溶解度,如果将导气管伸入液面下易产生倒吸,所以不能伸入液面下,碎瓷片有防暴沸作用,
所以答案是:吸收乙醇;中和乙酸;降低乙酸乙酯溶解度;防倒吸;防暴沸;(7)乙烯和溴发生加成反应生成CH2BrCH2Br,所以答案是:CH2BrCH2Br.


科目:高中化学 来源: 题型:
【题目】同温同压下相等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是( )
①分子数之比为11:16 ②体积比为16:11
③密度比为16:11 ④体积比为1:1.
A. ①③B. ②④C. ②③D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由氯化钾、氯化钙和盐酸组成的混合溶液,其c (K+)=0.2 mol·L-1,c(Ca2+)=0.4mol·L-1,c(Cl-)=1.2mol·L-1,则c(H+)为
A. 0.15mol·L-1 B. 0.2mol·L-1 C. 0.3mol·L-1 D. 0.4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A. 利用焰色反应可鉴别K2CO3溶液和Na2CO3溶液
B. 利用丁达尔效应可鉴别溶液和胶体
C. 运用蒸馏的方法,可以分离沸点相差较大的液体混合物
D. 广范pH试纸测得某碱性溶液的pH为12.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K+、Na+、CH3COO﹣、Br﹣
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO ![]() 、Cl﹣
、Cl﹣
C.0.1 molL﹣1 FeCl3溶液:K+、NH![]() 、I﹣、SCN﹣
、I﹣、SCN﹣
D.由水电离的c (H+)=1×10﹣14 molL﹣1的溶液中:Ca2+、K+、Cl﹣、HCO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室制取、净化并收集氯气涉及以下几个主要阶段:

现有以下2种试剂: A.饱和食盐水 B.NaOH溶液
请在以上试剂中选择填空(填“A”或“B”):
①写出上述制取氯气的离子方程式_____________________,X溶液应选用______。
②尾气处理过程中,多余的氯气可用______吸收,写出该过程的离子方程式_____。

(2)FeSO47H2O受热分解的化学方程式为:2FeSO47H2O ![]() Fe2O3+SO2↑+SO3↑+14 H2O
Fe2O3+SO2↑+SO3↑+14 H2O
请回答:
① FeSO47H2O俗名叫________矾,将其受热产生的气体按图示装置进行实验,证实含有SO3和SO2。 能说明SO2存在的实验现象是________;为测定BaSO4沉淀的质量,后续的操作步骤依次为________、洗涤、干燥、称重。
②设计一个实验方案,用化学方法验证FeSO4受热后固体的成分(不考虑其他反应)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4—、C2O42—,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
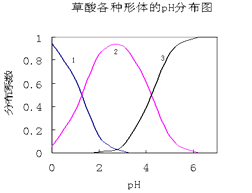
(1)图中曲线1表示________________的分布系数变化。
(2)现有物质的量浓度均为0.1mol/L的下列溶液:
a. Na2C2O4 b. NaHC2O4 c. H2C2O4 d. (NH4)2C2O4 e. NH4HC2O4
已知NaHC2O4溶液显酸性。
①NH4HC2O4显_____性(填“酸”、“碱”或“中”)
②Na2C2O4溶液中,![]() ____2 (填“>”、“=”、“<”), 原因是______________________________________________(用离子方程式表示)。
____2 (填“>”、“=”、“<”), 原因是______________________________________________(用离子方程式表示)。
③常温下,向10 mL 0. 1 mol/L H2C2O4溶液中滴加0.1 mol/L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,溶液显_______性(填“酸”、“碱”或“中”),且V(NaOH)______10 mL(填“>”、“=”或“<”)。
④五种溶液中c(H2C2O4)由大到小排列的顺序是 ________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com