
����Ŀ�����ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�ã���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ��������ش��������⣺ 
��1����X���缫����Ϊ����Y���缫����Ϊ���Ե缫��a�DZ���NaCl��Һ��ʵ�鿪ʼʱ��ͬʱ�����߸����뼸�η�̪��Һ����
�ٵ�����X���ϵĵ缫��Ӧʽ�� ��
�ڸ�װ�õ��ܷ�Ӧ����ʽΪ
��2����Ҫ�õ�ⷽ��������ͭ�����Һaѡ��CuSO4��Һ����
��X�缫�IJ����� �� Y�缫�IJ����� ��
��Y�缫�ĵ缫��Ӧʽ �� ��˵�������ʷ����ĵ缫��Ӧ����д����
��3����X������Ϊ�⻬���������Ѿ���������Y���IJ���Ϊп���������ҺaΪZnCl2 �� ��X���ĵ缫��ӦʽΪ
��Y���ĵ缫��ӦʽΪ
�۵������Һa��Ũ�Ƚ�������������١��������䡱��
���𰸡�
��1��2H++2e��=H2����2NaCl+2H2O ![]() 2NaOH+H2��+Cl2��
2NaOH+H2��+Cl2��
��2����ͭ����ͭ��Cu��2e��=Cu2+
��3��Zn2++2e��=Zn��Zn��2e��=Zn2+������
���������⣺��1����X���缫����Ϊ����Y���缫����Ϊ���Ե缫��a�DZ���NaCl��Һ���͵�Դ�ĸ��������ĵ缫X�����������õ缫�������ӷ����õ��ӵĻ�ԭ��Ӧ����2H++2e��=H2�������Ըõ缫����������Ũ����������ǿ�����뼸�η�̪��Һ���죬Y�缫�������ӷŵ������������缫��ӦʽΪ2Cl����2e��=Cl2������⻯ѧ����ʽΪ��2NaCl+2H2O ![]() 2NaOH+H2��+Cl2�������Դ��ǣ���2H++2e��=H2������2NaCl+2H2O
2NaOH+H2��+Cl2�������Դ��ǣ���2H++2e��=H2������2NaCl+2H2O ![]() 2NaOH+H2��+Cl2������2����Ҫ�õ�ⷽ��������ͭ�����Һaѡ��CuSO4��Һ������Ӧ���Ǵ�ͭ�������Ǵ�ͭ�������Դ��������������X�Ǵ�ͭ��������ͭ���ӷŵ磬�缫��ӦʽΪCu2++2e��=Cu�����Դ��������������Y�Ǵ�ͭ������������ӦΪ��Cu��2e��=Cu2+ ��
2NaOH+H2��+Cl2������2����Ҫ�õ�ⷽ��������ͭ�����Һaѡ��CuSO4��Һ������Ӧ���Ǵ�ͭ�������Ǵ�ͭ�������Դ��������������X�Ǵ�ͭ��������ͭ���ӷŵ磬�缫��ӦʽΪCu2++2e��=Cu�����Դ��������������Y�Ǵ�ͭ������������ӦΪ��Cu��2e��=Cu2+ ��
���Դ��ǣ��ٴ�ͭ����ͭ����Cu��2e��=Cu2+����3����X������Ϊ�⻬���������Ѿ���������Y���IJ���Ϊп���������ҺaΪZnCl2 �� �����Դ��������������X��п���ӷŵ磬�缫��ӦʽΪZn2++2e ��=Zn�����Դ��������������Y��пʧ���ӣ�����������ӦΪ��Zn����2e ��=Zn2+ �� �����������Һ���䣬���Ե������Һa��Ũ�Ƚ����䣻
���Դ��ǣ���Zn2++2e ��=Zn��Zn��2e ��=Zn2+���ڲ��䣮


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ʵ������ȡ���������ռ������漰���¼�����Ҫ�Σ�

��������2���Լ��� A������ʳ��ˮ B��NaOH��Һ
���������Լ���ѡ����գ�����A������B������
��д��������ȡ���������ӷ���ʽ_____________________��X��ҺӦѡ��______��
��β�����������У��������������______���գ�д���ù��̵����ӷ���ʽ_____��

��2��FeSO47H2O���ȷֽ�Ļ�ѧ����ʽΪ��2FeSO47H2O ![]() Fe2O3��SO2����SO3����14 H2O
Fe2O3��SO2����SO3����14 H2O
��ش�
�� FeSO47H2O������________�����������Ȳ��������尴ͼʾװ�ý���ʵ�飬֤ʵ����SO3��SO2�� ��˵��SO2���ڵ�ʵ��������________��Ϊ�ⶨBaSO4�����������������IJ�����������Ϊ________��ϴ�ӡ�������ء�
�����һ��ʵ�鷽�����û�ѧ������֤FeSO4���Ⱥ����ijɷ�(������������Ӧ)_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(H2C2O4)��һ��������ˮ�Ķ�Ԫ��ǿ�ᣬ��ˮ�����Ĵ�����̬��H2C2O4��HC2O4����C2O42��������̬�ķֲ�ϵ����Ũ�ȷ�����������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ��
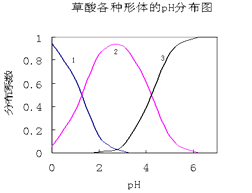
��1��ͼ������1��ʾ________________�ķֲ�ϵ���仯��
��2���������ʵ���Ũ�Ⱦ�Ϊ0.1mol/L��������Һ��
a. Na2C2O4 b. NaHC2O4 c. H2C2O4 d. (NH4)2C2O4 e. NH4HC2O4
��֪NaHC2O4��Һ�����ԡ�
��NH4HC2O4��_____��(������������������������)
��Na2C2O4��Һ����![]() ____2 (����>������=������<��)�� ԭ����______________________________________________�������ӷ���ʽ��ʾ����
____2 (����>������=������<��)�� ԭ����______________________________________________�������ӷ���ʽ��ʾ����
������������10 mL 0. 1 mol/L H2C2O4��Һ�еμ�0.1 mol/L NaOH��Һ������NaOH��Һ���������������Һ��c(Na+)��2c(C2O42-)+c(HC2O4-)ʱ����Һ��_______��(������������������������)����V��NaOH��______10 mL������>������=������<������
��������Һ��c(H2C2O4)�ɴ�С���е�˳���� ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����ö��ױ���һ��ͬ���칹���Ʊ�����Ⱦ��M�ĺϳ�·��ͼ��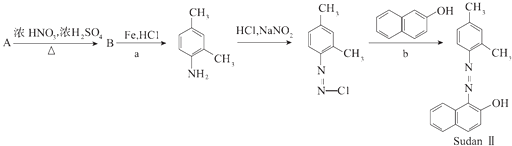
��1��a��Ӧ������Ӧ����Ϊ �� b��Ӧ������һС������ ��
��2��д��B�Ľṹ��ʽ ��
��3��C��A��Ϊͬ���칹�壬�������������ڵ�ȡ������C��һ��ȡ���������������֣�D������һ�֣������Ϻ�������ȡ������D�����Ը�����ط�Ӧ��E��E��һ�������������Ҷ�����Ӧ���ɸ߷��ӻ�����F��F��һ�������ĸ߷��Ӳ��ϣ�д�����з�Ӧ�Ļ�ѧ����ʽ����E�������NaOH��Һ��Ӧ �� ��E��F ��
��4������Ⱦ��M��һ�������¿ɽ�������  ����һ�ֺ����л�����G��G���Ӽ���������������Һ��Ӧ��Ҳ�������ᷴӦ��G�����е�Ԫ�ص���������Ϊ ��
����һ�ֺ����л�����G��G���Ӽ���������������Һ��Ӧ��Ҳ�������ᷴӦ��G�����е�Ԫ�ص���������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��������ʵ�����������ջ����ڹ������ʵij��������������ռ����ʹ��_______��
��2��д��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ��____________________________��
��3��Ư�۵���Ч�ɷ��� ____________________ ��
��4�������к���SiO2�����Կ�����______________����ʴ������
��5���Ƴ���������___________________�С�
��6�������кܴ��Σ������ֱ���ƻ�ũ���ɭ�֣���ԭ�ȣ����û�ѧ����ʽд��SO2�γ�����������Ĺ��̣�________________________ ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W���ֶ�����Ԫ�������ڱ��е�λ�ù�ϵ��ͼ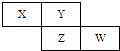
��1������ZԪ��ԭ�ӵ������������ǵ��Ӳ�����2����W�����ڱ��е�λ��Ϊ ��
��Y��ZԪ�ؿ���ɵĻ�����Ļ�ѧʽΪ ��
��д��ͭ��X�����������ˮ�����ϡ��Һ��Ӧ�����ӷ���ʽΪ ��
��W���������ˮ�����Ũ��Һ���ȶ������ȿɷֽ⣬����֮һ�ǻ���ɫ���壬�ҵ���28mol����ת��ʱ��������9mol���壬д���÷�Ӧ�Ļ�ѧ����ʽ ��
��2������Y��Z�ĺ��������֮��Ϊ22��Y����̬�⻯�����ʽΪ �� ��ҵ�ϳɸ����ʵĻ�ѧ����ʽΪ ��
�ڽ�X�����������ͨ�뵽��������Һ�У�ʵ�������� ��
��X������W�����������ˮ�����Ũ��Һ��Ӧ��������ת��0.4molʱ�����������������״���£��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4NH3��g��+5O2��g��=4NO��g��+6H2O��g����2L�ܱ������н���1���Ӻ�NH3������0.12mol����ƽ��ÿ����Ũ�ȱ仯��ȷ���ǣ� ��
A.NO��0.001 molL��1
B.H2O��0.002 molL��1
C.NH3��0.002 molL��1
D.O2��0.0025 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ֵ������Һ���ֱ������������������еĸ�һ�֣����һ����ظ���NH ![]() ��Ba2+��Na+��H+��SO
��Ba2+��Na+��H+��SO ![]() ��NO
��NO ![]() ��OH����CO
��OH����CO ![]() ������������Һ�ֱ���ΪA��B��C��D����������ʵ�飺 ����A��D�е���C�����г������ɣ� ��D��B��Ӧ���ɵ������ܱ�A���գ���A��D��Ӧ���ɵ������ܱ�B���գ� �Իش��������⣺
������������Һ�ֱ���ΪA��B��C��D����������ʵ�飺 ����A��D�е���C�����г������ɣ� ��D��B��Ӧ���ɵ������ܱ�A���գ���A��D��Ӧ���ɵ������ܱ�B���գ� �Իش��������⣺
��1��д�����������ʵĻ�ѧʽ��A �� B �� C �� D
��2��д��ʵ������йط�Ӧ�û�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����������װ��̽�������백���ķ�Ӧ������A��B�ֱ�Ϊ�����Ͱ����ķ���װ�ã�CΪ��������������백����Ӧ��װ�ã�
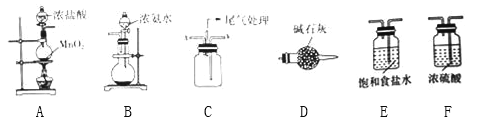
��1����Cl2��������������NH3��������������������ʵ��װ���У��������ӵĺ���˳��Ϊ��A��________________��B��ΪʹNH3��Cl2����ֻ�ϣ�Cl2Ӧ��Cװ�õ�__�ڽ��루�x����y������
��2������װ��A��ʹ�÷�Һ©����Բ����ƿ�еμ�Ũ����IJ�����__________________��
��3��װ��A�з�����Ӧ�����ӷ���ʽΪ_______________________________��
��4��װ��B��Բ����ƿ�ڵ��Լ�Ϊ______________�������ƣ���
��5��װ��D��������____________________________��
��6����Ӧ��ʼ��װ��C�ڳ���Ũ��İ��̲��������ڱ����ᣬ��һ�������ǿ����е���Ҫ�ɷ�֮һ���÷�Ӧ�Ļ�ѧ����ʽΪ________________________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com