
【题目】X、Y、Z、W四种短周期元素在周期表中的位置关系如图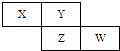
(1)Ⅰ若Z元素原子的最外层电子数是电子层数的2倍①W在周期表中的位置为 .
②Y和Z元素可组成的化合物的化学式为 .
③写出铜和X的最高价氧化物水化物的稀溶液反应的离子方程式为 .
④W最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28mol电子转移时,共产生9mol气体,写出该反应的化学方程式 .
(2)Ⅱ若Y和Z的核外电子数之和为22①Y的气态氢化物电子式为 , 工业合成该物质的化学方程式为 .
②将X的最高价氧化物通入到苯酚钠溶液中,实验现象是 .
③X单质与W的最高价氧化物水化物的浓溶液反应,当电子转移0.4mol时,产生气体体积(标准状况下)是 .
【答案】
(1)第三周期ⅦA族;SO2、SO3;3Cu+2NO3﹣+8H+=3Cu2++2NO↑+4H2O;4HClO4 ![]() 2Cl2↑+7O2↑+2H2O
2Cl2↑+7O2↑+2H2O
(2) ;N2+3H2
;N2+3H2 ![]() 2NH3;溶液变浑浊;6.72L
2NH3;溶液变浑浊;6.72L
【解析】解:X、Y、Z、W四种短周期元素,由元素在周期表的位置关系可知,X、Y处于第二周期,Z、W处于第三周期,(1)Ⅰ、若Z元素原子的最外层电子数是电子层数的2倍,则Z最外层电子数为6,故Z为硫元素,由元素在周期表中的相对位置可知,X为氮元素、Y为氧元素、W为Cl元素;①W为Cl元素,原子核外电子数为3,有3个电子层,最外层电子数为7,故处于周期表第三周期ⅦA族,
所以答案是:第三周期ⅦA族;
②氧元素与硫元素组成的化合物为:SO2、SO3 ,
所以答案是:SO2、SO3;
③铜与稀硝酸反应生成硝酸铜、NO与水,反应离子方程式为:3Cu+2NO3﹣+8H+=3Cu2++2NO↑+4H2O,
所以答案是:3Cu+2NO3﹣+8H+=3Cu2++2NO↑+4H2O;
④高氯酸浓溶液不稳定,受热可分解,产物之一是黄绿色气体,该气体为氯气,根据电子转移守恒可知,氧元素被氧化生成氧气,由氢元素守恒,还原水生成,当有28mol电子转移时,得到氯气为 ![]() =2mol,生成氧气为9mol﹣2mol=7mol,故反应方程式为:4HClO4
=2mol,生成氧气为9mol﹣2mol=7mol,故反应方程式为:4HClO4 ![]() 2Cl2↑+7O2↑+2H2O,
2Cl2↑+7O2↑+2H2O,
所以答案是:4HClO4 ![]() 2Cl2↑+7O2↑+2H2O;(2)Ⅱ、若Y和Z的核外电子数之和为22,令Y的核外电子数为y,则Z的核外电子数为y+8,则y+y+8=22,解得y=7,故Y为氮元素、Z为磷元素,则X为碳元素、W为硫元素;
2Cl2↑+7O2↑+2H2O;(2)Ⅱ、若Y和Z的核外电子数之和为22,令Y的核外电子数为y,则Z的核外电子数为y+8,则y+y+8=22,解得y=7,故Y为氮元素、Z为磷元素,则X为碳元素、W为硫元素;
①氨气分子中N原子成3个N﹣H键,N原子还原1对孤对电子,故氨气分子的电子式为  ,工业合成氨气的化学方程式为N2+3H2
,工业合成氨气的化学方程式为N2+3H2 ![]() 2NH3 ,
2NH3 ,
所以答案是: 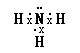 ;N2+3H2
;N2+3H2 ![]() 2NH3;
2NH3;
②碳酸的酸性比苯酚强,反应生成苯酚,通常条件下苯酚溶解性不大,溶液变浑浊,
所以答案是:溶液变浑浊;
③碳与浓硫酸反应生成二氧化碳、二氧化硫,当电子转移0.4mol时,n(SO2)= ![]() =0.2mol、n(CO2)=
=0.2mol、n(CO2)= ![]() =0.1mol,故标准状况下产生气体的体积为(0.2mol+0.1mol)×22.4L/mol=6.72L,
=0.1mol,故标准状况下产生气体的体积为(0.2mol+0.1mol)×22.4L/mol=6.72L,
所以答案是:6.72L.


科目:高中化学 来源: 题型:
【题目】某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热. 

(1)下列说法不正确的是
A.该实验也可在保温杯中进行
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失
D.若将盐酸体积改为60mL,两次实验所求得中和热不相等
(2)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(3)将一定量的稀氨水、稀氢氧化钠溶液、稀氢氧化钡溶液分别和1L 1molL﹣1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3 , 则△H1、△H2、△H3的大小关系为
(4)若将V1mL1.0molL﹣1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解CuSO4溶液。若阳极上产生气体的物质的量为0.010 0 mol,则阴极上析出Cu的质量为 ( )
A.0.64 g
B.1.28 g
C.2.56 g
D.5.12 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,错误的是
A.有了化学科学,人类能够更好利用能源和资源
B.化学科学将为环境问题的解决提供有力的保障
C.化学研究会造成严重的环境污染,最终人类将会毁灭在化学物质中
D.化学家可以制造出自然界中不存在的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 
(1)若X极电极材料为铁,Y极电极材料为惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式是 .
②该装置的总反应方程式为
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 , Y电极的材料是 ,
②Y电极的电极反应式 . (说明:杂质发生的电极反应不必写出)
(3)若X极材料为光滑的铁钉(已经处理),Y极的材料为锌,电解质溶液a为ZnCl2 , ①X极的电极反应式为
②Y极的电极反应式为
③电解质溶液a的浓度将(填“增大”、“减少”、“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知98%的浓硫酸的物质的量浓度为18.4mol/L,则49%的硫酸的物质的量浓度 ( )
A. 等于9.2 mo1/L B. 小于 9.2 mo1/L
C. 大于 9.2 mo1/L D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离或提纯,不可能选用蒸馏、过滤、萃取分液的是( )
A. 除去粗盐溶液中混有的泥沙B. 从碘水中提取碘
C. 从氯化钠溶液中获取氯化钠D. 分离酒精和水的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝能够在空气中稳定存在的原因是( )
A. 性质不活泼,不与空气中的成分反应 B. 镁、铝与氧气的反应速率极慢
C. 经过了特殊工艺处理 D. 与氧气反应形成了氧化物保护膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com