
【题目】下列说法中,错误的是
A.有了化学科学,人类能够更好利用能源和资源
B.化学科学将为环境问题的解决提供有力的保障
C.化学研究会造成严重的环境污染,最终人类将会毁灭在化学物质中
D.化学家可以制造出自然界中不存在的物质
科目:高中化学 来源: 题型:
【题目】将4molA气体和3molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g),
若经 2s后测得 C的浓度为 0.6molL﹣1 , 现有下列几种说法:
①用物质A 表示反应的平均速率为 0.3molL﹣1s﹣1
②物质 B的体积分数是40%
③2s 时物质 A 的转化率为30%
④2s 时物质 B 的浓度为 1.0molL﹣1
其中正确的是( )
A.①④
B.②③
C.①③
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O ![]() 和CrO
和CrO ![]() ,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种. 方法1:还原沉淀法
,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种. 方法1:还原沉淀法
该法的工艺流程为④③②①
CrO ![]()
![]() Cr2O72﹣
Cr2O72﹣ ![]() Cr3+
Cr3+ ![]() Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42(黄色)+2H+Cr2O72﹣(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显色.
(2)能说明第①步反应达平衡状态的是 . a.Cr2O ![]() 和CrO42的浓度相同
和CrO42的浓度相同
b.2v(Cr2O ![]() )=v(CrO42)
)=v(CrO42)
c.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O72﹣离子,需要mol的FeSO47H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH﹣(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH﹣)=10﹣32 , 要使c(Cr3+)降至10﹣5 mol/L,溶液的pH应调至 .
方法2:电解法
该法用Fe做电极电解含 Cr2O72﹣的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)用Fe做电极的原因为 .
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) , 溶液中同时生成的沉淀还有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。
(1)判断离子AB2-离子的空间构型为__________。A、B、C 3种元素第一电离能由大到小的顺序为__________________ 。(用相应的元素符号表示)
(2)元素A、C形成的化合物熔点很高,但比B、C形成的化合物熔点低,其原因是_________。
(3)在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是___________。
(4)元素B与D形成的一种化合物广泛应用于录音磁带上,其晶胞如右图所示。该化合物的化学式为___________。

(5)向D的氯化物DCl3溶液中滴加氨水可形成配合物[D(NH3)3(H2O)Cl2]Cl。
①离子D3+的核外电子排布式为_________________。
②1 mol该配合物中含配位键的数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用二甲苯的一种同分异构体制备新型染料M的合成路线图.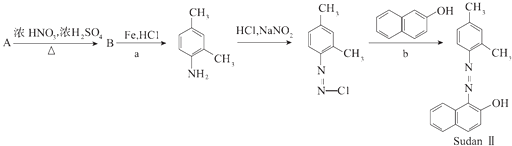
(1)a反应所属反应类型为 , b反应生成另一小分子是 .
(2)写出B的结构简式 .
(3)C与A互为同分异构体,含有两个不相邻的取代基,C的一氯取代产物最多可能有种;D是其中一种,苯环上含有三个取代基,D与酸性高锰酸钾反应得E,E在一定条件下能与乙二醇反应生成高分子化合物F,F是一种优良的高分子材料.写出下列反应的化学方程式:①E与过量热NaOH溶液反应 . ②E→F .
(4)新型染料M在一定条件下可降解生成  和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为 .
和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入A(g)和B(g),它们的初始浓度均为2molL﹣1 , 在一定条件下发生反应:A(g)+B(g)2C(g).该温度下,此反应的平衡常数为4,则A的转化率为( )
A.30%
B.40%
C.50%
D.60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在周期表中的位置关系如图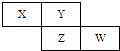
(1)Ⅰ若Z元素原子的最外层电子数是电子层数的2倍①W在周期表中的位置为 .
②Y和Z元素可组成的化合物的化学式为 .
③写出铜和X的最高价氧化物水化物的稀溶液反应的离子方程式为 .
④W最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28mol电子转移时,共产生9mol气体,写出该反应的化学方程式 .
(2)Ⅱ若Y和Z的核外电子数之和为22①Y的气态氢化物电子式为 , 工业合成该物质的化学方程式为 .
②将X的最高价氧化物通入到苯酚钠溶液中,实验现象是 .
③X单质与W的最高价氧化物水化物的浓溶液反应,当电子转移0.4mol时,产生气体体积(标准状况下)是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O,用贮存很久的漂白粉和浓盐酸反应制得的氯气中,可能含有的气体杂质为①CO2 , ②HCl,③H2O,④O2中的 ( )
A.①②③
B.②③④
C.①②③④
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A和B的原子序数都小于18。已知A元素原子最外层电子数为a,次外层电子数为b;B元素原子的M层电子数是a-b,L层电子数是a+b,则A、B两元素所形成的化合物的晶体类型为
A.分子晶体B.原子晶体C.离子晶体D.金属晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com