
【题目】用如图所示仪器(内含物质)组装成实验装置,可验证木炭与浓H2SO4反应生成CO2,下列有关说法正确的是( )
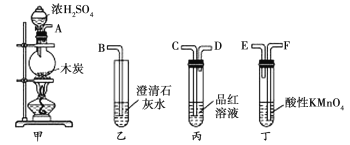
A.上述装置连接的正确顺序是A→E→F→C→D→B
B.SO2和CO2都可与澄清石灰水反应,且原理相同
C.只需观察到乙中澄清石灰水变浑浊这一个现象,即可验证生成CO2
D.将SO2通入酸性高锰酸钾溶液,溶液褪色,体现SO2的漂白性
【答案】B
【解析】
装置甲进行浓硫酸和木炭的反应,生成的气体为SO2和CO2的混合气体,本实验要利用澄清石灰水验证二氧化碳,二氧化硫会影响对二氧化碳的检验,所以需要先用酸性高锰酸钾溶液将二氧化硫除去,然后通入品红溶液检验二氧化硫是否除尽,之后再通入澄清石灰水检验二氧化碳。
A.根据分析可知,正确的连接顺序为A→F→E→C→D→B,故A错误;
B.二氧化硫和二氧化碳均为酸性氧化物,与澄清石灰水反应均生成相应的难溶于水的含氧酸盐(CaSO3和CaCO3)和水,原理相同,故B正确;
C.二氧化硫会影响对二氧化碳的检验,所以需要确定二氧化硫是否除尽,当观察到品红不褪色时,说明二氧化硫被除尽,此时澄清石灰水变浑浊才能说明生成CO2,故C错误;
D.二氧化硫具有还原性,能被酸性高锰酸钾氧化从而使其褪色,并不是漂白性,故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】近年来将氯化氢转化为氯气的技术成为科学研究的热点。
(1)迪肯发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为密闭容器中, 进料浓度比 c(HCl) ∶c(O2)分别等于 1∶1、4∶1、7∶1 时 HCl 平衡转化率随温度 变化的关系:
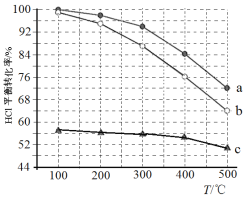
①据图像可知反应平衡常数 K(300℃)______K(400℃),(填“>”或“<”)。判 断理由是:________________________________________________;
②若进料浓度比 c(HCl) ∶c(O2)等于 1∶1,400℃时,O2 的转化率是______。
(2)Deacon 直接氧化法可按下列催化过程进行:CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH1=-20 kJ·mol-1,CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH2=-121 kJ·mol-1,4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
若是利用ΔH1和ΔH2计算ΔH3时,还需要利用__________反应的ΔH。
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计 了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
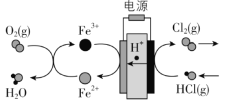
阴极区发生的反应有Fe3+ + e- = Fe2+和___________________(写反应方程式)。
电路中转移1 mol电子,可生成氯气__________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.2 mol·L1Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L1CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L1Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42,含有Cu+、Cu2+和SO32。
已知:Cu+![]() Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32。

a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu+和SO32的理由是___________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.呗Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。

步骤二:_____________(按上图形式呈现)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
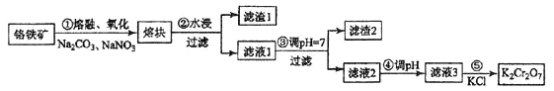
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下:
i. SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+SO2=SO![]() +4H++2I-
+4H++2I-
序号 | ① | ② | ③ | ④ |
试剂 组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验 现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较①快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较①快 |
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中),下列说法不正确的是
A. 水溶液中SO2歧化反应方程式为:3SO2+2H2O =S↓+2H2SO4
B. ②是①的对比实验,则a=0.4
C. 比较①、②、③,可得出结论:I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可加快歧化反应速率
D. 实验表明,SO2的歧化反应速率④>①,原因是反应i比ii快,反应ii中产生的H+是反应i加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置在实验室进行氨的催化氧化实验。

已知:NO2在高于150℃时不稳定,容易分解成NO和O2
(1)氨的催化氧化反应的化学方程式为___。
(2)广口瓶c中观察到红棕色气体,是因为___。
(3)实验发现,停止加热直玻璃管后,短时间直玻璃管内仍未观察到红棕色气体,说明直玻璃管中反应是___反应(填“吸热”或“放热”)。
(4)停止通O2,持续通NH3,广口瓶C中红棕色慢慢褪去,出现大量白烟,可能是生成了___。
(5)实验室检验NH3的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表情包、斗图是新媒体时代的产物,微信热传的“苯宝宝表情包”可看作是由苯衍生的物质配以相应文字形成的(如图)。下列有关说法正确的是( )

A. A 物质与 D 物质互为同系物
B. 邻二甲苯只有一种结构,能证明苯环中不存在碳碳单键和碳碳双键交替的结构
C. B 物质是由的1mol 苯与3mol 氯气在光照的条件下发生取代反应而制备得到的
D. C 物质是苯的同系物,其二溴代物有7 种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com