
����Ŀ��ij��ѧ��ȤС��������ͼװ����ʵ���ҽ��а��Ĵ�����ʵ�顣

��֪��NO2�ڸ���150��ʱ���ȶ������ֽ��NO��O2
��1�����Ĵ�������Ӧ�Ļ�ѧ����ʽΪ___��
��2�����ƿc�й۲쵽����ɫ���壬����Ϊ___��
��3��ʵ�鷢�֣�ֹͣ����ֱ�����ܺ�ʱ��ֱ����������δ�۲쵽����ɫ���壬˵��ֱ�������з�Ӧ��___��Ӧ(��������������������)��
��4��ֹͣͨO2������ͨNH3�����ƿC�к���ɫ������ȥ�����ִ������̣�������������___��
��5��ʵ���Ҽ���NH3�ķ�����___��
���𰸡�4NH3+5O2![]() 4NO+6H2O ������NO2 ���� NH4NO3(�����) ��ʪ��ĺ�ɫʯ����ֽ���飬��ֽ����֤����NH3
4NO+6H2O ������NO2 ���� NH4NO3(�����) ��ʪ��ĺ�ɫʯ����ֽ���飬��ֽ����֤����NH3
��������
(1) �����ڴ������¿ɱ���������NO��ˮ��
(2) һ������������ƿc�кͿ����е�������Ӧ���ɺ���ɫ�������������
(3) NO2�ڸ����»�ֽ⣬ֹͣ����ֱ�����ܺ�ʱ��ֱ����������δ�۲쵽����ɫ���壬˵���÷�Ӧ�Ƿ��ȷ�Ӧ��
(4)ƿ�ڵ�NO2��ˮ������Ӧ�������ᣬ����ͨNH3�������ٺ����ᷴӦ�����˰�ɫ��NH4NO3���塣
(1) �����ڴ������¿ɱ���������NO��ˮ������ʽΪ��4NH3+5O2![]() 4NO+6H2O���ʴ�Ϊ��4NH3+5O2
4NO+6H2O���ʴ�Ϊ��4NH3+5O2![]() 4NO+6H2O��
4NO+6H2O��
(2) һ������������ƿc�кͿ����е�������Ӧ���ɺ���ɫ��������������ʴ�Ϊ��������NO2��
(3) ����֪������NO2�ڸ���150��ʱ���ȶ������ֽ��NO��O2��ֹͣ����ֱ�����ܺ�ʱ����δ�۲쵽����ɫ���壬˵��ֱ�������з�Ӧ�Ƿ��ȷ�Ӧ����ά���¶�һ��ʱ�䣬�ʴ�Ϊ�����ȣ�
(4) ƿ���а������ɣ�����������ƿ����ˮ�������ڣ�NO2��ˮ������Ӧ�������ᣬ�����ٺ����ᷴӦNH3+HNO3=NH4NO3�������˰�ɫ��NH4NO3���壬�ʴ�Ϊ��NH4NO3(�����)��
(5)ʵ������ʪ��ĺ�ɫʯ����ֽ���鰱�����ʴ�Ϊ����ʪ��ĺ�ɫʯ����ֽ���飬��ֽ����֤����NH3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ĿǰӦ����㷺�ĵ��������ѳ�����ԭ��Ϊ��4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ��H=��11.63 kJ/mol��������������ʱ����2 L�ܱ�������ʹ�ò�ͬ�Ĵ���X��Y��Z������n(N2)��ʱ��ı仯����ͼ��ʾ������˵������ȷ����
5N2(g)+6H2O(g) ��H=��11.63 kJ/mol��������������ʱ����2 L�ܱ�������ʹ�ò�ͬ�Ĵ���X��Y��Z������n(N2)��ʱ��ı仯����ͼ��ʾ������˵������ȷ����
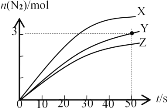
A.�ô���X��Z���ﵽƽ��ʱ��N2����һ��
B.�ô���Yǰ50 sƽ����Ӧ����v(NH3)=0.03 mol/(Ls)
C.�������ϵ�е�H2O(g)��������������������ѳ���
D.����ϵ������״̬���ֲ��䣬��Ӧ���κ��¶��¾����Է�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ӧ�� ���칤������ͭ��д��������ͭ�����ã���ɽ���¯��ֹ�г�ͭ����¯��ʯ����Ǧ�κͣ�תɫΪ��ͭ������˪��ҩ����Ϊ��ͭ����������ҩ����Ϊ��ͭ�������κ�Ϊ��ͭ����Ǧ��д�zк�{Ϊ��ͭ��������һζ��ͭ���ѡ����ش��������⣺
(1)������������Ǧ����Ҫ�ɷֲ���Ǧ������һ��λ�ڵ������ڵĹ���Ԫ�أ����̬ԭ�ӵĵ����ܲ���ܼ�ȫ����������ԭ����Χ���ӵ��Ų�ʽΪ��________________________
(2)��CuSO4��Һ�мӹ�����ˮ���������Һ�м���һ�����Ҵ�������[Cu(NH3)4]SO4��H2O��д���˹�������ɫ��״�����μӹ�����ˮ�����ӷ�Ӧ����ʽ________________________________________��[Cu(NH3)4]SO4��H2O����Cu2���γ���λ����ԭ����________(��Ԫ�ط���)����Ҫȷ��[Cu(NH3)4]SO4��H2O�Ǿ��廹�ǷǾ��壬���ѧ�ķ����Ƕ������_________________ʵ�顣
(3)���б�Ԫ�ص��ε���ɫ��ӦΪ_______ɫ����������ζ����Է�����ɫ��Ӧ����ԭ����______________________
(4)��ͭ������Ҫ����ͭԭ�ϣ�CuFeS2������ͭ����Ҫ������ʽ���ķ���ϵCuFeS2�����ṹ��ͼ��ʾ��
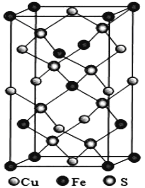
��Cu������λ��Ϊ__________��
����֪���ױ�a��b��0.524 nm����c��1.032 nm��NAΪ�����ӵ�������ֵ,CuFeS2������ܶ���___________gcm3(�г��������ʽ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ����(�ں�����)��װ��ʵ��װ�ã�����֤ľ̿��ŨH2SO4��Ӧ����CO2�������й�˵����ȷ���ǣ� ��
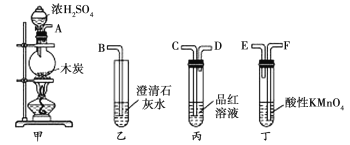
A.����װ�����ӵ���ȷ˳����A��E��F��C��D��B
B.SO2��CO2���������ʯ��ˮ��Ӧ����ԭ����ͬ
C.ֻ��۲쵽���г���ʯ��ˮ�������һ����������֤����CO2
D.��SO2ͨ�����Ը��������Һ����Һ��ɫ������SO2��Ư����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����![]() ��H2CO3 ��
��H2CO3 ��![]() ��HCO3������Ҫ��
��HCO3������Ҫ�� ת��Ϊ
ת��Ϊ![]() ���еķ�����( )
���еķ�����( )
A. ������NaOH��Һ���ȣ���ͨ������HClB. ��ϡ���Ṳ�Ⱥ���������NaHCO3
C. ���ȸ�������Һ����ͨ��������CO2D. ��ϡ���Ṳ�Ⱥ��ټ�������NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�ػ��ϼ������ʵ��������άͼ���������������ʷ��༰ת����������������Ԫ����ض�άͼ�ش����⡣

��1��X�ĵ���ʽΪ__����̬�⻯���ȶ��ԣ�H2O__x(������������������������)
��2������̬������Z__����(����������������������)������ǿ����___H3PO4(������������������������)��
��3����X��Y��ϣ������ɵ���ɫ���塣�÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ__��
��4��ʵ����������T����������ΪNa2SO4����Ƽ�ʵ�鷽��������֤___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽ����ͼ������л���ɷ����ķ�Ӧ������( )
��ȡ����Ӧ�ڼӾ۷�Ӧ����ȥ��Ӧ��������Ӧ��ˮ�ⷴӦ��������Ӧ����ɫ��Ӧ

A. �٢ڢܢޢ�B. �ڢۢܢޢ�C. �٢ڢۢܢݢ�D. ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����(SOCl2)��һ��Һ̬������е�Ϊ77������ũҩ����ҩ��ҵ����;�㷺��SOCl2��ˮ���ҷ�Ӧ��Һ���ϲ��������������д̼�����ζ�����������ʵ���Һϳ�ԭ����SO2��Cl2��SCl2=2SOCl2����������ƿ����ȡSOCl2���ش���������

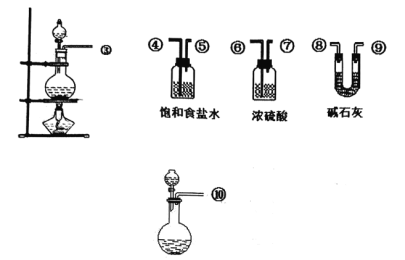
(1)ʵ������Cl2�����ӷ���ʽΪ____________��
(2)c����������____________����ˮ�ķ����Ǵ�____________�ڽ�ˮ��
(3)ʵ������ȡSOCl2��������ƿ�н��У�����װ����ѡ����������˳����____________���٣���������������(����װ�ÿ����ظ�ʹ��)��
(4)�����������ӵĸ����f�������ǣ���ֹ�����е�ˮ�������뷴Ӧװ�ö�ʹSOCl2ˮ�⡢____________��
(5)����ʵ������д��SOCl2��ˮ���ҷ�Ӧ�Ļ�ѧ��Ӧ����ʽ____________��
(6)ʵ�������������ƿ�л������뿪��ʵ�����������____________(��֪SCl2�ķе�Ϊ50��)������Ӧ������Cl2�����Ϊ448mL(��ת��Ϊ��״����SO2����)�����õ�������SOCl23.808g����SOCl2�IJ���Ϊ____________��(����=ʵ�ʲ���/���۲�����100%)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��5���л���ѧ����]
�Է����廯����A���л���DΪԭ�ϣ��Ʊ��л���M�߾���N��һ�ֺϳ�·�����£�
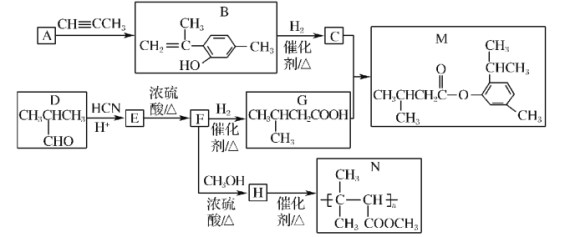
��֪��I��A��B��ԭ��������Ϊ100%��
��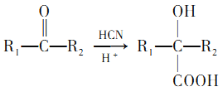 ��R1��R2��ʾ��ԭ�ӻ���������
��R1��R2��ʾ��ԭ�ӻ���������
��ش��������⣺
��1��A�Ľṹ��ʽΪ___________��
��2��D�Ļ�ѧ����Ϊ___________��
��3��F��H�ķ�Ӧ����Ϊ___________��
��4��C+G��M�Ļ�ѧ����Ϊ______________________��
��5��ͬʱ��������������B��ͬ���칹����___________�֣������������칹����
�ٱ�������������ȡ���������ܷ���������Ӧ��
��6�����������ϳ�·�ߺ���Ϣ������ϩΪԭ�ϣ����Լ���ѡ��������Ʊ�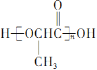 �ĺϳ�·��______��
�ĺϳ�·��______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com