
【题目】近年来将氯化氢转化为氯气的技术成为科学研究的热点。
(1)迪肯发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为密闭容器中, 进料浓度比 c(HCl) ∶c(O2)分别等于 1∶1、4∶1、7∶1 时 HCl 平衡转化率随温度 变化的关系:
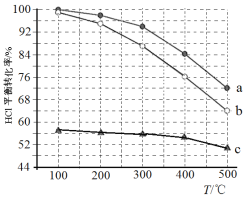
①据图像可知反应平衡常数 K(300℃)______K(400℃),(填“>”或“<”)。判 断理由是:________________________________________________;
②若进料浓度比 c(HCl) ∶c(O2)等于 1∶1,400℃时,O2 的转化率是______。
(2)Deacon 直接氧化法可按下列催化过程进行:CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH1=-20 kJ·mol-1,CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH2=-121 kJ·mol-1,4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
若是利用ΔH1和ΔH2计算ΔH3时,还需要利用__________反应的ΔH。
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计 了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
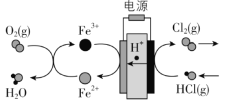
阴极区发生的反应有Fe3+ + e- = Fe2+和___________________(写反应方程式)。
电路中转移1 mol电子,可生成氯气__________L(标准状况)。
【答案】> 图像表明,进料浓度比相同时温度升高HCl的平衡转化率降低,说明平衡逆向移动,生成物浓度降低,反应物浓度升高,K值越小。 21% CuCl2(s)=CuCl(s)+![]() Cl2(g) 或CuCl(s)+
Cl2(g) 或CuCl(s)+![]() Cl2(g) = CuCl2(s) 4Fe2++O2+4H+=4Fe3++2H2O 11.2
Cl2(g) = CuCl2(s) 4Fe2++O2+4H+=4Fe3++2H2O 11.2
【解析】
(1)①根据图知,进料浓度比c(HCl):c(O2)一定时,升高温度,HCl的转化率降低,说明平衡逆向移动,升高温度平衡向吸热方向移动,则正反应为放热反应,温度越高,化学平衡常数越小。
②温度一定时,进料浓度比c(HCl):c(O2)越大,HCl的转化率越小,400℃进料浓度比c(HCl):c(O2)=1:1时,HCl的转化率为a曲线,HCl转化率为84%,根据三段式:
4HCl(g)+O2(g)2Cl2(g)+2H2O(g)
开始(mol/L) c0c000
反应(mol/L) 0.84c00.21c00.42c00.42c0
平衡(mol/L) 0.16c00.79c00.42c00.42c0
计算氧气的转化率。
(2)①CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH1=-20 kJ·mol-1;
②CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH2=-121 kJ·mol-1;
③4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
若是利用ΔH1和ΔH2计算ΔH3时,由盖斯定律,![]() ③-②-①得:需要利用CuCl2(s)=CuCl(s)+
③-②-①得:需要利用CuCl2(s)=CuCl(s)+![]() Cl2(g)或CuCl(s)+
Cl2(g)或CuCl(s)+![]() Cl2(g) = CuCl2(s)的ΔH。
Cl2(g) = CuCl2(s)的ΔH。
(3)由图可知,H+向左侧移动,则左侧为电解池的阴极,阴极上发生还原反应,根据图示信息可知,其阴极电极反应式为:Fe3++e-=Fe2+和4Fe2++O2+4H+=4Fe3++2H2O,右侧为阳极,阳极电极反应式为:2HCl-2e-=Cl2↑+2H+。
(1)①根据图知,进料浓度比c(HCl):c(O2)一定时,升高温度,HCl的转化率降低,说明平衡逆向移动,升高温度平衡向吸热方向移动,则正反应为放热反应,温度越高,化学平衡常数越小,所以K(300℃)>K(400℃),故答案为:>;图像表明,进料浓度比相同时温度升高HCl的平衡转化率降低,说明平衡逆向移动,生成物浓度降低,反应物浓度升高,K值越小。
②温度一定时,进料浓度比c(HCl):c(O2)越大,HCl的转化率越小,400℃进料浓度比c(HCl):c(O2)=1:1时,HCl的转化率为a曲线,HCl转化率为84%,根据三段式:
4HCl(g)+O2(g)2Cl2(g)+2H2O(g)
开始(mol/L) c0c000
反应(mol/L) 0.84c00.21c00.42c00.42c0
平衡(mol/L) 0.16c00.79c0
则氧气的转化率为:![]() ,故答案为:
,故答案为:![]() 。
。
(2)①CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH1=-20 kJ·mol-1;
②CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH2=-121 kJ·mol-1;
③4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
若是利用ΔH1和ΔH2计算ΔH3时,由盖斯定律,![]() ③-②-①得:需要利用CuCl2(s)=CuCl(s)+
③-②-①得:需要利用CuCl2(s)=CuCl(s)+![]() Cl2(g) 或CuCl(s)+
Cl2(g) 或CuCl(s)+![]() Cl2(g) = CuCl2(s)的ΔH,故答案为:CuCl2(s)=CuCl(s)+
Cl2(g) = CuCl2(s)的ΔH,故答案为:CuCl2(s)=CuCl(s)+![]() Cl2(g) 或CuCl(s)+
Cl2(g) 或CuCl(s)+![]() Cl2(g) = CuCl2(s)。
Cl2(g) = CuCl2(s)。
(3)由图可知,H+向左侧移动,则左侧为电解池的阴极,阴极上发生还原反应,根据图示信息可知,其阴极电极反应式为:Fe3++e-=Fe2+和4Fe2++O2+4H+=4Fe3++2H2O,右侧为阳极,阳极电极反应式为:2HCl-2e-=Cl2↑+2H+,电路中转移1mol电子,生成0.5molCl2,其标准状况下的体积为![]() ,故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
,故答案为:4Fe2++O2+4H+=4Fe3++2H2O;![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列反应中,水既不做氧化剂,又不做还原剂的是( )
A. Cl2+H2O=HCl+HClO B. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C. 2Na+2H2O=2NaOH+H2↑ D. 2F2+2H2O=4HF+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境保护是目前人类面临的一项重大课题。为应对燃料使用造成的环境污染,科学家提出了利用太阳能促进燃料循环使用的构想,其构想可用下图表示:
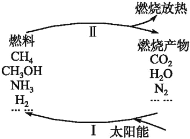
其中过程Ⅰ的主要反应为①2CO2![]() 2CO+O2,②2H2O
2CO+O2,②2H2O![]() 2H2↑+O2↑,③2N2+6H2O
2H2↑+O2↑,③2N2+6H2O![]() 4NH3+3O2,④2CO2+4H2O
4NH3+3O2,④2CO2+4H2O![]() 2CH3OH+3O2,⑤CO2+2H2O
2CH3OH+3O2,⑤CO2+2H2O![]() CH4+2O2。
CH4+2O2。
下列说法中不正确的是
A.过程Ⅱ中发生的反应均为放热反应
B.太阳能最终主要转化为热能
C.经过上述一个循环后放出O2
D.要实现上述循环,当前需要解决的关键问题是过程Ⅰ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造海绵的主要成分是聚氨酯,合成方法如下:
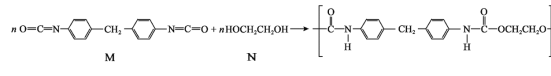
下列说法正确的是( )
A.M 属于芳香烃B.N 与乙醇互为同系物
C.合成聚氨酯的反应属于缩聚反应D.聚氨酯在一定条件下可发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,0.1mol/L HCl溶液中由水电离出的H+的浓度为_______;
(2)若向氨水中加入少量硫酸铵固体,此时溶液中![]() 将_______;(填“增大”、“减小”或“不变”)
将_______;(填“增大”、“减小”或“不变”)
(3)25℃时,向AgNO3溶液中加入BaCl2溶液和KBr溶液,当两种沉淀共存时,![]() =____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
=____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
(4)用离子方程式表示NH4F不能用玻璃试剂瓶装的原因________;
(5)25℃时,有下列四种溶液:A. 0.1mol/L CH3COONH4溶液 B. 0.1mol/L CH3COOH溶液 C.0.1mol/L CH3COONa溶液 D.等体积0.4mol/L CH3COOH溶液和0.2mol/L NaOH溶液的混合液(混合液呈酸性)
① 已知A溶液呈中性,试推断(NH4)2CO3溶液呈______性(填“酸”或“碱”或“中”);
② D溶液中除H2O外所有分子、离子浓度由大到小的顺序为________;
③ 上述四种溶液中水的电离程度由小到大的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究 FeCl3 溶液与 Na2SO3 溶液之间的反应,进行如下实验探究
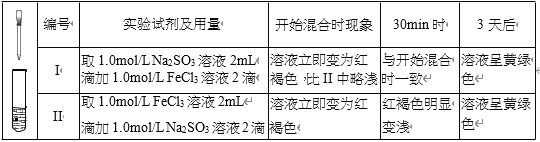
(1)配制 FeCl3 溶液时,先将 FeCl3 溶于浓盐酸,再稀释至指定浓度。结合化学用语说 明浓盐酸的作用:______。
(2)甲同学认为,上述实验在开始混合时观察到的现象不涉及氧化还原反应,实验 I中红褐色比 II 中略浅的原因是______。
(3)乙同学认为实验 II 可能发生了氧化还原反应,为了探究反应的产物做了实验 III和生成物检验。

① 取少量 Na2SO3 溶液电极附近的混合液,加入______,产生白色沉淀,证明产生了 SO42-。
② 该同学又设计实验探究另一电极的产物,取少量FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生____________________,证明产生了Fe2+。
(4)实验 III 发生反应的方程式是______。
(5)实验小组查阅资料:溶液中 Fe3+、 SO32-、OH-三种微粒会形成红色配合物并存在如下转化:
![]()
从反应速率和化学平衡两个角度解释实验 I、II 现象背后的原因可能是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前应用最广泛的氮氧化物脱除技术原理为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol。其他条件不变时,在2 L密闭容器中使用不同的催化剂X、Y、Z,产生n(N2)随时间的变化如下图所示。下列说法不正确的是
5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol。其他条件不变时,在2 L密闭容器中使用不同的催化剂X、Y、Z,产生n(N2)随时间的变化如下图所示。下列说法不正确的是
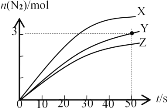
A.用催化剂X与Z,达到平衡时,N2产率一样
B.用催化剂Y前50 s平均反应速率v(NH3)=0.03 mol/(Ls)
C.分离出体系中的H2O(g)有利于提升氮氧化物的脱除率
D.若体系各物质状态保持不变,则反应在任何温度下均可自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
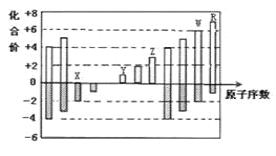
A.原子半径:Z>Y>X
B.Y和Z两者最高价氧化物对应的水化物之间能相互反应
C.WX3和水反应形成的化合物是离子化合物
D.气态氢化物的热稳定性:W>R
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示仪器(内含物质)组装成实验装置,可验证木炭与浓H2SO4反应生成CO2,下列有关说法正确的是( )
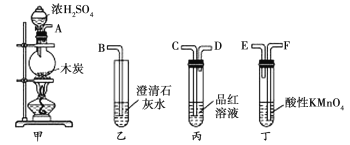
A.上述装置连接的正确顺序是A→E→F→C→D→B
B.SO2和CO2都可与澄清石灰水反应,且原理相同
C.只需观察到乙中澄清石灰水变浑浊这一个现象,即可验证生成CO2
D.将SO2通入酸性高锰酸钾溶液,溶液褪色,体现SO2的漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com