
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
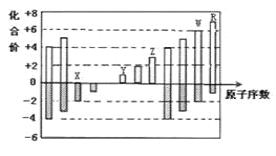
A.原子半径:Z>Y>X
B.Y和Z两者最高价氧化物对应的水化物之间能相互反应
C.WX3和水反应形成的化合物是离子化合物
D.气态氢化物的热稳定性:W>R
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】随原子序数的递增,五种短周期元素原子半径与原子序数的关系如图所示:
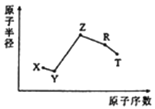
己知:TX2是现代光学及光纤制品的基本原料:ZY能破坏水的电离平衡:Z3RY6在工业上常用作助熔剂。下列说法不正确的是
A.R在元素周期表中的位置是第三周期第ⅢA族
B.上述元素中的某两种元素可组成一种五原子共价化合物,该化合物的电子式为![]() 或
或![]()
C.工业上以Z3RY6作助熔剂的目的是降低氧化铝沸点,节约冶炼铝的原料
D.己知11.5 g Z的单质在X2中完全燃烧,恢复至室温,放出Q kJ热量,该反应的热化学方程式为2Na(s)+O2(g)=Na2O2(s) △H=-4Q kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来将氯化氢转化为氯气的技术成为科学研究的热点。
(1)迪肯发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为密闭容器中, 进料浓度比 c(HCl) ∶c(O2)分别等于 1∶1、4∶1、7∶1 时 HCl 平衡转化率随温度 变化的关系:
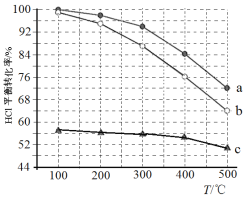
①据图像可知反应平衡常数 K(300℃)______K(400℃),(填“>”或“<”)。判 断理由是:________________________________________________;
②若进料浓度比 c(HCl) ∶c(O2)等于 1∶1,400℃时,O2 的转化率是______。
(2)Deacon 直接氧化法可按下列催化过程进行:CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH1=-20 kJ·mol-1,CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH2=-121 kJ·mol-1,4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
若是利用ΔH1和ΔH2计算ΔH3时,还需要利用__________反应的ΔH。
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计 了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
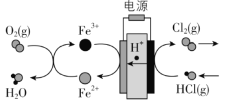
阴极区发生的反应有Fe3+ + e- = Fe2+和___________________(写反应方程式)。
电路中转移1 mol电子,可生成氯气__________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及铁的化合物在生活、生产中具有广泛应用,如亚铁氰化钾即K4[Fe(CN)6]是食盐中常用的抗结剂、铁基(氟掺杂镨氧铁砷化合物)是高温超导材料、“愚人金”是制备硫酸的主要矿物原料。请按要求回答下列问题。
(1)K4[Fe(CN)6]配合物中存在的作用力类型有__________________________(从“金属键”、“离子键”、“共价键”、“配位键”、“氢键”、“范德华力”中选填);其中CN-中各原子最外层均满足8电子稳定结构,其电子式为___________________,其中C原子的杂化形式是_____________。
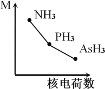
(2)铁基化合物中氟、氧、砷三种元素中电负性值由大到小的顺序是_____________(填元素符号)。其中氢化物(RH3)的某种性能(M)随R的核电荷数的变化趋势如图所示,则纵轴M可能表示为_____________________(从“沸点”、“稳定性”、“分子间作用力”、“R—H键能”中选填)。
(3)FeCl3晶体熔点为306 ℃,而FeF3晶体熔点高于1000 ℃,试解释两种化合物熔点差异较大的原因:____________________________________________。
(4)结合下表数据,所得结论:I1(Cu)<I1(Fe),而I2(Cu)>I2(Fe)。请用所学理论解释:________________________________________。

(5)“愚人金”是铁硫化合物,其晶体的晶胞如上右图所示。该晶体的化学式为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着化工产业的迅猛发展,氯化氢转化为氯气的技术成为科学研究的热点。请按要求回答下列问题:
(1)HCl直接氧化法制Cl2可按下列催化过程进行:
CuCl2(s)=CuCl(s)+1/2Cl2(g) ΔH1 = +83 kJ·mol-1
CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH2 = -20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3 = -121 kJ·mol-1
写出HCl直接氧化法制Cl2的热化学方程式:____________________________。
(2)在恒定容器中用上述HCl直接氧化法制Cl2,进料c(HCl) ∶c(O2)分别为1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如下图所示:
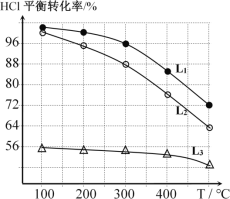
①判断图中c(HCl) /c(O2) = 1:1的曲线为________。
②按化学计量系数比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料时c(HCl)/c(O2)过低、过高的不利影响分别是____________、________。
③综合上述信息,写出在一定温度的条件下进一步提高HCl的转化率的方法: ________________________________________。
④观察上图,以任何一条曲线为例,平衡常数K(200℃)________K(300℃)(填“大于”、“小于”或“等于”)。
⑤设O2初始浓度为c,计算L2对应K(300℃) =____________(列出含c的计算式)。
(3)科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
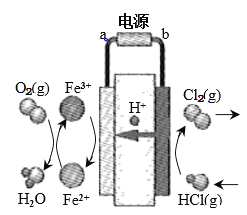
①电源b极为____________极。
②写出阳极区域反应方程式:________________________________________。
③电路中转移1 mol电子时,阳极产生气体体积为__________________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5(也可写为:NH4H),它的所有原子的最外层均满足2个或8个电子的稳定结构。则下列有关说法中错误的是( )
A.它与水反应的化学方程式为NH5 + H2O ═ NH3H2O + H2↑
B.NH5中既有共价键又有离子键
C.NH5的电子式为 
D.1 mol NH5中含有5NA个N﹣H键(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.2 mol·L1Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L1CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L1Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42,含有Cu+、Cu2+和SO32。
已知:Cu+![]() Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32。

a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu+和SO32的理由是___________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.呗Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。

步骤二:_____________(按上图形式呈现)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
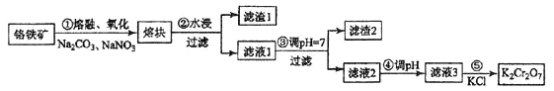
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表情包、斗图是新媒体时代的产物,微信热传的“苯宝宝表情包”可看作是由苯衍生的物质配以相应文字形成的(如图)。下列有关说法正确的是( )

A. A 物质与 D 物质互为同系物
B. 邻二甲苯只有一种结构,能证明苯环中不存在碳碳单键和碳碳双键交替的结构
C. B 物质是由的1mol 苯与3mol 氯气在光照的条件下发生取代反应而制备得到的
D. C 物质是苯的同系物,其二溴代物有7 种同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com