
【题目】铁及铁的化合物在生活、生产中具有广泛应用,如亚铁氰化钾即K4[Fe(CN)6]是食盐中常用的抗结剂、铁基(氟掺杂镨氧铁砷化合物)是高温超导材料、“愚人金”是制备硫酸的主要矿物原料。请按要求回答下列问题。
(1)K4[Fe(CN)6]配合物中存在的作用力类型有__________________________(从“金属键”、“离子键”、“共价键”、“配位键”、“氢键”、“范德华力”中选填);其中CN-中各原子最外层均满足8电子稳定结构,其电子式为___________________,其中C原子的杂化形式是_____________。
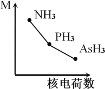
(2)铁基化合物中氟、氧、砷三种元素中电负性值由大到小的顺序是_____________(填元素符号)。其中氢化物(RH3)的某种性能(M)随R的核电荷数的变化趋势如图所示,则纵轴M可能表示为_____________________(从“沸点”、“稳定性”、“分子间作用力”、“R—H键能”中选填)。
(3)FeCl3晶体熔点为306 ℃,而FeF3晶体熔点高于1000 ℃,试解释两种化合物熔点差异较大的原因:____________________________________________。
(4)结合下表数据,所得结论:I1(Cu)<I1(Fe),而I2(Cu)>I2(Fe)。请用所学理论解释:________________________________________。

(5)“愚人金”是铁硫化合物,其晶体的晶胞如上右图所示。该晶体的化学式为______________。

【答案】离子键、共价键、配位键 [:C![]() N:]- sp杂化 F>O>As 稳定性、R—H键能 F比Cl的电负性大,FeF3为离子晶体,FeCl3为分子晶体 主要原因是Cu电子排布式为[Ar]3d104s1,失去一个电子变为[Ar]3d10,此时3d能级全满,能量较低,此时再失去第二个电子即3d10中的1个电子所需能量较大(或Fe电子排布式为[Ar]3d64s2,失去一个电子变为[Ar]3d64s1,此时再失去第二个电子即4s1中的电子所需能量较小) FeS2
N:]- sp杂化 F>O>As 稳定性、R—H键能 F比Cl的电负性大,FeF3为离子晶体,FeCl3为分子晶体 主要原因是Cu电子排布式为[Ar]3d104s1,失去一个电子变为[Ar]3d10,此时3d能级全满,能量较低,此时再失去第二个电子即3d10中的1个电子所需能量较大(或Fe电子排布式为[Ar]3d64s2,失去一个电子变为[Ar]3d64s1,此时再失去第二个电子即4s1中的电子所需能量较小) FeS2
【解析】
(1)配合物中主要含有离子键、共价键、配位键;因CN-各原子均满足8电子稳定结构,故CN-的电子式为[:C![]() N:]-;根据VSEPR模型计算C原子的杂化类型为sp杂化;
N:]-;根据VSEPR模型计算C原子的杂化类型为sp杂化;
(2)原子的电负性同一周期从左到右依次增大、同一主族从上到下依次减小,故F、O、As的电负性从大到小为F>O>As;因N、P、As三者的非金属性一次减弱,故M可能是稳定性或者R-H键能;
(3)F的电负性较强,FeCl3为分子晶体,微粒之间的作用力是分子间作用力,FeF3位离子键晶体,微粒之间的作用力是离子键,故FeF3的熔点较高;
(4)主要原因是Cu电子排布式为[Ar]3d104s1,失去一个电子变为[Ar]3d10,此时3d能级全满,较稳定能量较低,此时再失去第二个电子需要较大的能量;
(5)从晶体结构中可以看出,Fe2+分布在8个定点和6个面心,故晶胞中含有![]() =4个Fe2+,S22-分布在12条棱和体心上,故晶胞中含有
=4个Fe2+,S22-分布在12条棱和体心上,故晶胞中含有![]() =4个S22-,故分子式为FeS2。
=4个S22-,故分子式为FeS2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如图所示(部分生成物已略去)。其中,A为黑色固体;C、D为金属单质,且D为红色;H为红棕色粉末,常用作红色油漆和涂料。
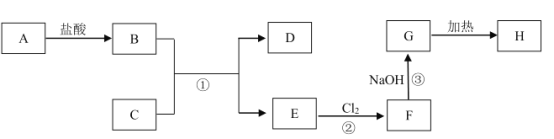
(1)写出物质H的化学式:___。
(2)写出下列反应的离子方程式:反应②___,反应③___。
(3)向E溶液中滴入NaOH溶液时,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。写出沉淀由白色变成红褐色的化学方程式:___。
(4)印刷电路板是由高分子材料和金属D复合而成的。刻制印刷电路时,要用过量的F溶液作为“腐蚀液”,其在刻制过程中作___(填“氧化”或“还原”)剂,写出该反应的离子方程式:___。
(5)某同学通过实验实现了反应F→E的转化,为了检验F是否完全转化为E,设计如下实验方案:取少量F于试管中,加水溶解,并滴加KSCN溶液,再向其中加入粉末C,振荡。当观察到___现象时,证明F完全转化为E。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造海绵的主要成分是聚氨酯,合成方法如下:
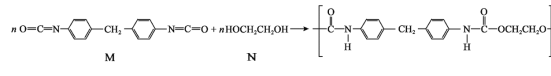
下列说法正确的是( )
A.M 属于芳香烃B.N 与乙醇互为同系物
C.合成聚氨酯的反应属于缩聚反应D.聚氨酯在一定条件下可发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究 FeCl3 溶液与 Na2SO3 溶液之间的反应,进行如下实验探究
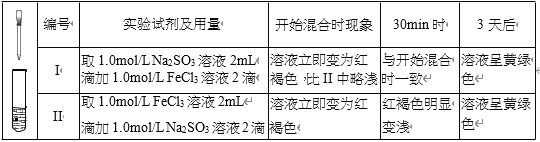
(1)配制 FeCl3 溶液时,先将 FeCl3 溶于浓盐酸,再稀释至指定浓度。结合化学用语说 明浓盐酸的作用:______。
(2)甲同学认为,上述实验在开始混合时观察到的现象不涉及氧化还原反应,实验 I中红褐色比 II 中略浅的原因是______。
(3)乙同学认为实验 II 可能发生了氧化还原反应,为了探究反应的产物做了实验 III和生成物检验。

① 取少量 Na2SO3 溶液电极附近的混合液,加入______,产生白色沉淀,证明产生了 SO42-。
② 该同学又设计实验探究另一电极的产物,取少量FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生____________________,证明产生了Fe2+。
(4)实验 III 发生反应的方程式是______。
(5)实验小组查阅资料:溶液中 Fe3+、 SO32-、OH-三种微粒会形成红色配合物并存在如下转化:
![]()
从反应速率和化学平衡两个角度解释实验 I、II 现象背后的原因可能是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前应用最广泛的氮氧化物脱除技术原理为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol。其他条件不变时,在2 L密闭容器中使用不同的催化剂X、Y、Z,产生n(N2)随时间的变化如下图所示。下列说法不正确的是
5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol。其他条件不变时,在2 L密闭容器中使用不同的催化剂X、Y、Z,产生n(N2)随时间的变化如下图所示。下列说法不正确的是
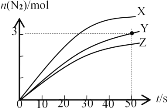
A.用催化剂X与Z,达到平衡时,N2产率一样
B.用催化剂Y前50 s平均反应速率v(NH3)=0.03 mol/(Ls)
C.分离出体系中的H2O(g)有利于提升氮氧化物的脱除率
D.若体系各物质状态保持不变,则反应在任何温度下均可自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A. CH4、SF6、二氯乙烯(反式)、H2O2都是含极性键的非极性分子
B. 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键
C. 酸性:H2CO3<H3PO4<HNO3<HClO4
D. CO的一种等电子体为NO+,它的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
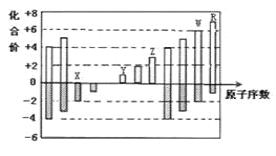
A.原子半径:Z>Y>X
B.Y和Z两者最高价氧化物对应的水化物之间能相互反应
C.WX3和水反应形成的化合物是离子化合物
D.气态氢化物的热稳定性:W>R
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国发射宇宙飞船的 “神舟”系列火箭用偏二甲肼(C2H8N2)作燃料,液态四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
(1)写出反应的化学方程式: _______________________________。
(2)该反应是________(填“放热”或“吸热”)反应,反应物的总能量________(填“大于”、“小于”或“等于”)生成物的总能量,断开化学键________的总能量________(填“大于”、“小于”或“等于”)形成化学键________的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“元素化合价—物质的类别”二维图清晰的体现了物质分类及转化的情况。请根据硫元素相关二维图回答问题。

(1)X的电子式为__,气态氢化物稳定性:H2O__x(填“>”、“=”或“<”)
(2)熔融态下物质Z__导电(填“可以”或“不可以”),酸性强弱:___H3PO4(填“>”、“=”或“<”)。
(3)将X与Y混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为__。
(4)实验室中物质T有少量变质为Na2SO4,设计简单的实验方案予以验证___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com