
【题目】下列有关说法不正确的是
A. CH4、SF6、二氯乙烯(反式)、H2O2都是含极性键的非极性分子
B. 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键
C. 酸性:H2CO3<H3PO4<HNO3<HClO4
D. CO的一种等电子体为NO+,它的电子式为![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如图:

(1)第①步加稀H2SO4时,粗MnO2样品中的__(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是_Mn2++_ClO3-+_H2O=_MnO2↓+_Cl2↑+_H+。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯、__、__,已知蒸发得到的固体中有NaClO3和NaOH,则一定还含有__(写化学式)
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7gMnO2,并收集到0.224LCO2(标准状况下),则在第②步反应中至少需要__molNaClO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量可以用来衡量一个国家的石油化工发展水平。B是一种密度比水小的油状液体,B仅由碳、氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式为______________,A的结构式为__________________。
(2)与A分子组成相差一个CH2原子团的A的同系物C与溴的四氯化碳溶液反应的化学方程式为_______________________,反应类型为_______________。
(3)在碘水中加入B振荡静置后的现象是_________________。
(4)B与浓硫酸、浓硝酸在50~60℃下反应的化学方程式为_____________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在一个小烧杯里加入研细的20g Ba(OH)2·8H2O晶体。将此小烧杯放在事先滴有3~4滴水的玻璃片上,然后向小烧杯中加入10g NH4Cl晶体,并用玻璃棒快速搅拌。

(1)实验中要用玻璃棒搅拌的原因是________________;
(2)写出有关反应的化学方程式:________________,该反应__________(填“是”或“不是”)氧化还原反应。
(3)该实验中观察到的现象除产生刺激性气味的气体及反应混合物呈糊状以外,还有_________________________。
(4)通过最后一个现象可以说明该反应为_________(填“吸”或“放”)热反应,这是由于反应物的总能量_________(填“大于”或“小于”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及铁的化合物在生活、生产中具有广泛应用,如亚铁氰化钾即K4[Fe(CN)6]是食盐中常用的抗结剂、铁基(氟掺杂镨氧铁砷化合物)是高温超导材料、“愚人金”是制备硫酸的主要矿物原料。请按要求回答下列问题。
(1)K4[Fe(CN)6]配合物中存在的作用力类型有__________________________(从“金属键”、“离子键”、“共价键”、“配位键”、“氢键”、“范德华力”中选填);其中CN-中各原子最外层均满足8电子稳定结构,其电子式为___________________,其中C原子的杂化形式是_____________。
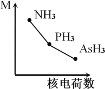
(2)铁基化合物中氟、氧、砷三种元素中电负性值由大到小的顺序是_____________(填元素符号)。其中氢化物(RH3)的某种性能(M)随R的核电荷数的变化趋势如图所示,则纵轴M可能表示为_____________________(从“沸点”、“稳定性”、“分子间作用力”、“R—H键能”中选填)。
(3)FeCl3晶体熔点为306 ℃,而FeF3晶体熔点高于1000 ℃,试解释两种化合物熔点差异较大的原因:____________________________________________。
(4)结合下表数据,所得结论:I1(Cu)<I1(Fe),而I2(Cu)>I2(Fe)。请用所学理论解释:________________________________________。

(5)“愚人金”是铁硫化合物,其晶体的晶胞如上右图所示。该晶体的化学式为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表给出的几种物质的熔沸点数据,判断下列说法中错误的是
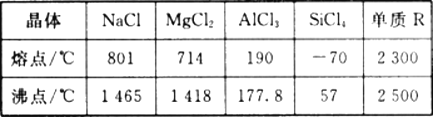
A. SiCl4 和A1Cl3都是分子晶体 ,熔融状态下不导电
B. MgCl2和NaCl都是离子晶体,熔融状态能导电且易溶于水
C. 若单质R是原子晶体,其熔沸点的高低是由共价键的键能决定的
D. 固态时可导电的一定是金属晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5(也可写为:NH4H),它的所有原子的最外层均满足2个或8个电子的稳定结构。则下列有关说法中错误的是( )
A.它与水反应的化学方程式为NH5 + H2O ═ NH3H2O + H2↑
B.NH5中既有共价键又有离子键
C.NH5的电子式为 
D.1 mol NH5中含有5NA个N﹣H键(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是

A. ![]() 的数量级为
的数量级为![]()
B. 除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]() =2CuCl
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
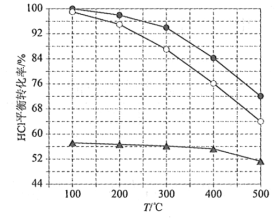
可知反应平衡常数K(300℃)____________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=____________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是____________。
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
(3)在一定温度的条件下,进一步提高HCI的转化率的方法是______________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
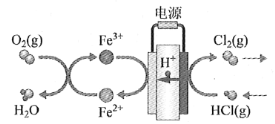
负极区发生的反应有____________________(写反应方程式)。电路中转移1 mol电子,需消耗氧气__________L(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com