
����Ŀ������������Ŀǰ�������ٵ�һ���ش���⡣ΪӦ��ȼ��ʹ����ɵĻ�����Ⱦ����ѧ�����������̫���ܴٽ�ȼ��ѭ��ʹ�õĹ��룬�乹�������ͼ��ʾ��
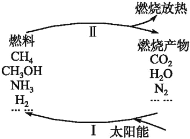
���й��̢����Ҫ��ӦΪ��2CO2![]() 2CO+O2����2H2O
2CO+O2����2H2O![]() 2H2��+O2������2N2+6H2O
2H2��+O2������2N2+6H2O![]() 4NH3+3O2����2CO2+4H2O
4NH3+3O2����2CO2+4H2O![]() 2CH3OH+3O2����CO2+2H2O
2CH3OH+3O2����CO2+2H2O![]() CH4+2O2��
CH4+2O2��
����˵���в���ȷ����
A.���̢��з����ķ�Ӧ��Ϊ���ȷ�Ӧ
B.̫����������Ҫת��Ϊ����
C.��������һ��ѭ����ų�O2
D.Ҫʵ������ѭ������ǰ��Ҫ����Ĺؼ������ǹ��̢�
 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪̼̼���������Ƽ���������ת���ṹ��ʽΪ��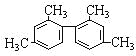 ����������˵����ȷ���ǣ� ��
����������˵����ȷ���ǣ� ��
A.������������9��̼ԭ�Ӵ���ͬһƽ����
B.������������11��̼ԭ�Ӵ���ͬһƽ����
C.������������16��̼ԭ�Ӵ���ͬһƽ����
D.�������ڱ���ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��г��ˢ١���ʮ��Ԫ�������ڱ��е�λ�ã�
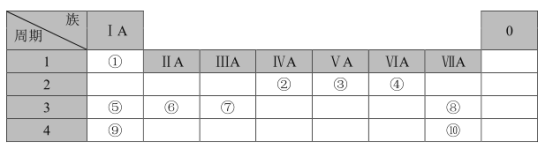
�밴Ҫ��ش��������⣺
��1��Ԫ�آݵ�ԭ�ӽṹʾ��ͼΪ___��Ԫ�آڵ����������ĵ���ʽ��___��
��2���ݡ��ޡ�������Ԫ��ԭ�Ӱ뾶�ɴ�С��˳����___����Ԫ�ط��ţ���������Ԫ������������Ӧˮ�����м�����ǿ����___���ѧʽ����
��3���ۡ���Ԫ�صļ��⻯����ȶ��Խ�������___���ѧʽ����
��4���١��ڡ�������Ԫ���γɵ��л���ķ��ӽṹģ����ͼ��ʾ��д�����л���Ľṹ��ʽ��___����������γɵ����ϩ����������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽ��___��

��5��Ԫ�آߵ�����������Ӧ��ˮ����������������Һ��Ӧ�����ӷ���ʽ��___��
��6��д��Ԫ�آ�ĵ�����ˮ��Ӧ�Ļ�ѧ����ʽ��___��
��7�����ԭ�ӽṹ�ĽǶȽ��ͣ�Ԫ�آ�ǽ����Ա�Ԫ�آ�ǿ��ԭ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�������ĵ��������ֶ�����Ԫ��ԭ�Ӱ뾶��ԭ�������Ĺ�ϵ��ͼ��ʾ��
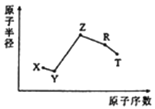
��֪��TX2���ִ���ѧ��������Ʒ�Ļ���ԭ�ϣ�ZY���ƻ�ˮ�ĵ���ƽ�⣺Z3RY6�ڹ�ҵ�ϳ��������ۼ�������˵������ȷ����
A.R��Ԫ�����ڱ��е�λ���ǵ������ڵڢ�A��
B.����Ԫ���е�ij����Ԫ�ؿ����һ����ԭ�ӹ��ۻ�����û�����ĵ���ʽΪ![]() ��
��![]()
C.��ҵ����Z3RY6�����ۼ���Ŀ���ǽ����������е㣬��Լұ������ԭ��
D.��֪11.5 g Z�ĵ�����X2����ȫȼ�գ��ָ������£��ų�Q kJ�������÷�Ӧ���Ȼ�ѧ����ʽΪ2Na(s)+O2(g)=Na2O2(s) ��H=-4Q kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��зḻ�ĵ�Ԫ�أ���ͼ��ʵ���ҴӺ�������ȡ�IJ������̣�
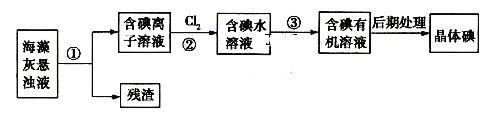
�����жϲ���ȷ����
A.����١��۵IJ����ֱ��ǹ��ˡ���ȡ��Һ
B.������з�Ӧ�����ӷ���ʽΪ��![]()
C.���õ�����Һ���鲽����еķ�Ӧ�Ƿ������ȫ
D.������м�����л��ܼ�������![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳɰ���Ӧ��N2��3H2![]() 2NH3��һ�����ȵĿ��淴Ӧ����Ӧ�����Ǹ��¡���ѹ��������Ҫ���ʵĴ�������֪�γ�1 mol H��H����1 mol N��H����1 mol N��N���ų������ֱ�Ϊ436 kJ��391 kJ��946 kJ����
2NH3��һ�����ȵĿ��淴Ӧ����Ӧ�����Ǹ��¡���ѹ��������Ҫ���ʵĴ�������֪�γ�1 mol H��H����1 mol N��H����1 mol N��N���ų������ֱ�Ϊ436 kJ��391 kJ��946 kJ����
��1����1 mol N2��ȫ��Ӧ����NH3��________(����ա��ų���)����________kJ��
��2�������1 mol N2��3 mol H2��ϣ�ʹ���ַ�Ӧ���ų���������С��������ֵ����ԭ����________________________��
��3��ʵ����ģ�ҵ�ϳɰ�ʱ�����ݻ�Ϊ2 L���ܱ������ڣ���Ӧ����10 min������10 mol NH3������N2��ʾ�Ļ�ѧ��Ӧ����Ϊ________mol��L��1��min��1��
��4��һ�������£����ϳɰ��ķ�Ӧ�ﵽ��ѧƽ��ʱ������˵����ȷ����________��
a������Ӧ���ʺ��淴Ӧ�������
b������Ӧ��������淴Ӧ����Ϊ0
c��N2��ת���ʴﵽ���ֵ
d��N2��H2��Ũ�����
e��N2��H2��NH3������������
f����Ӧ�ﵽ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B��C�������������ģ����ͼ:
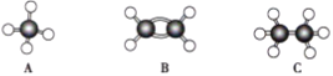
(1).������������������ȫȼ��ʱ��ȥO2����������______(���Ӧ��ĸ����ͬ)
(2).ͬ״����ͬ�������������������ȫȼ��ʱ��ȥO2����������______
(3).��������������������ȼ��ʱ������ˮ������______
(4).��120�桢1.01��105Pa������ʱ����������̬����������������ϵ�ȼ����ͬ�����²�÷�Ӧǰ���������û�з����仯��������������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ���ת��Ϊ�����ļ�����Ϊ��ѧ�о����ȵ㡣
��1���ϿϷ�����ֱ��������Ϊ��4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)����ͼΪ�ܱ������У� ����Ũ�ȱ� c(HCl) ��c(O2)�ֱ���� 1��1��4��1��7��1 ʱ HCl ƽ��ת�������¶� �仯�Ĺ�ϵ��
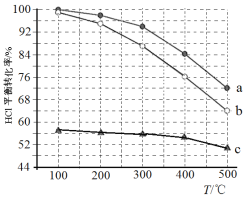
�پ�ͼ���֪��Ӧƽ�ⳣ�� K��300�棩______K��400�棩��������>������<�������� �������ǣ�________________________________________________��
��������Ũ�ȱ� c(HCl) ��c(O2)���� 1��1��400��ʱ��O2 ��ת������______��
��2��Deacon ֱ���������ɰ����д����̽��У�CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ��H1=-20 kJ��mol-1��CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ��H2=-121 kJ��mol-1��4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ��H3
����������H1����H2������H3ʱ������Ҫ����__________��Ӧ����H��
��3���ڴ�ͳ�ĵ���Ȼ���������������Ļ����ϣ���ѧ���������̼���缫������� ��һ���µĹ��շ�������Ҫ�����绯ѧ���̺ͻ�ѧ���̣�����ͼ��ʾ��
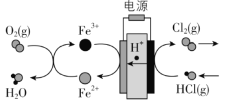
�����������ķ�Ӧ��Fe3+ + e- = Fe2+��___________________��д��Ӧ����ʽ����
��·��ת��1 mol���ӣ�����������__________L����״������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na2SO3��Һ�Ͳ�ͬ��������������Һ��Ϊʵ�����̽���ε����ʺ�����Һ�䷴Ӧ�Ķ����ԡ�
ʵ�� | �Լ� | ���� | |
�ι� | �Թ� | ||
| 0.2 mol��L1Na2SO3��Һ | ����Ag2SO4��Һ | ��.������ɫ���� |
0.2 mol��L1CuSO4 | ��.��Һ���̣������μӲ����ػ�ɫ���� | ||
0.1 mol��L1Al2��SO4��3��Һ | ��.��ʼ�����Ա仯�������μӲ�����ɫ���� | ||
��1�������飬�������еİ�ɫ������Ag2SO3�������ӷ���ʽ������������____________��
��2�������飬���������ػ�ɫ�����в���SO42������Cu+��Cu2+��SO32��
��֪��Cu+![]() Cu +Cu2+��Cu2+
Cu +Cu2+��Cu2+![]() CuI������ɫ��+I2��
CuI������ɫ��+I2��
����ϡ����֤ʵ�����к���Cu+��ʵ��������_____________��
��ͨ������ʵ��֤ʵ�������к���Cu2+��SO32��

a.��ɫ����A��BaSO4���Լ�1��____________��
b.֤ʵ�����к���Cu+��SO32��������___________��
��3����֪��Al2��SO3��3��ˮ��Һ�в����ڡ������飬�������İ�ɫ��������SO42���ð�ɫ������������ǿ�ᣬ��������ǿ�����ʹ����KMnO4��Һ��ɫ��
���Ʋ�����к������������________��
�����ڳ�������������Ĵ�����ʽ������ּ��裺i.��Al��OH��3��������ii.���������ļ�ʽ���С��Լ���ii����˶Ա�ʵ�飬֤ʵ�˼���ii������
a.���Ա�ʵ�鷽������������

�������_____________������ͼ��ʽ���֣���
��4������ʵ�飬�������ε�������___________������Һ�䷴Ӧ�Ķ�������__________�йء�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com