
【题目】(1)25℃时,0.1mol/L HCl溶液中由水电离出的H+的浓度为_______;
(2)若向氨水中加入少量硫酸铵固体,此时溶液中![]() 将_______;(填“增大”、“减小”或“不变”)
将_______;(填“增大”、“减小”或“不变”)
(3)25℃时,向AgNO3溶液中加入BaCl2溶液和KBr溶液,当两种沉淀共存时,![]() =____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
=____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
(4)用离子方程式表示NH4F不能用玻璃试剂瓶装的原因________;
(5)25℃时,有下列四种溶液:A. 0.1mol/L CH3COONH4溶液 B. 0.1mol/L CH3COOH溶液 C.0.1mol/L CH3COONa溶液 D.等体积0.4mol/L CH3COOH溶液和0.2mol/L NaOH溶液的混合液(混合液呈酸性)
① 已知A溶液呈中性,试推断(NH4)2CO3溶液呈______性(填“酸”或“碱”或“中”);
② D溶液中除H2O外所有分子、离子浓度由大到小的顺序为________;
③ 上述四种溶液中水的电离程度由小到大的顺序为________。
【答案】10-13 mol/L 减小 2.7×10-3 F-+H2O![]() HF+OH- 或NH4++F-+H2O
HF+OH- 或NH4++F-+H2O![]() HF+NH3·H2O 碱 c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) B<D<C<A
HF+NH3·H2O 碱 c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) B<D<C<A
【解析】
(1)氯化氢为强电解质,氢离子浓度等于氯化氢的物质的量浓度,根据水的离子积计算出该溶液中水电离的氢氧根离子浓度,水电离的氢离子浓度等于氢氧根离子浓度;
(2)向氨水中加入少量硫酸铵固体,铵根离子浓度增大,抑制氨水的电离,溶液中氢氧根离子浓度减小,一水合氨分子浓度增大;
(3)当两种沉淀共存时,溶液是AgCl和AgBr的饱和溶液,溶液中![]() =
=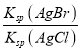 ,依此计算;
,依此计算;
(4)NH4F在溶液中水解生成HF,二氧化硅能溶于HF;
(5)①0.1mol/L CH3COONH4溶液呈中性,说明铵根离子的水解程度与醋酸根离子的水解程度相同,即氨水和CH3COOH的电离程度相同,因为醋酸的酸性比碳酸的强,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,据此判断;②等体积0.4mol/L CH3COOH溶液和0.2mol/L NaOH溶液的混合液中含有等浓度的醋酸钠和醋酸,因为溶液显酸性,说明醋酸的电离程度大于醋酸根的水解程度,据此分析排序;③ 根据酸和碱抑制水的电离,能够水解的盐促进水的电离,结合离子间的相互影响分析判断。
(1)在25℃时,在0.1mol/L HCl溶液中,c(H+)=c(HCl)=0.1mol/L,氯化氢溶液中的氢氧根离子是水电离的,则由水电离出的c(H+)水=c(OH-)=![]() mol/L=1×10-13 mol/L,故答案为:1×10-13 ;
mol/L=1×10-13 mol/L,故答案为:1×10-13 ;
(2)由于(NH4)2SO4=2NH4++SO42-,溶液中NH4+浓度增大,抑制氨水电离,导致溶液中氢氧根离子浓度减小,一水合氨分子浓度增大,所以此时溶液中![]() 减小,故答案为:减小;
减小,故答案为:减小;
(3)当两种沉淀共存时,溶液中Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=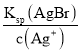 ,c(Cl-)=
,c(Cl-)=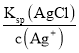 ,则
,则![]() =
=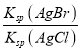 =
=![]() =2.7×10-3,故答案为:2.7×10-3;
=2.7×10-3,故答案为:2.7×10-3;
(4)NH4F在溶液中水解生成HF,其水解方程式为:F-+H2O![]() HF+OH-或NH4++F-+H2O
HF+OH-或NH4++F-+H2O![]() HF+NH3·H2O,玻璃中的二氧化硅能溶于HF,其反应为:4HF+SiO2═SiF4↑+2H2O,故答案为:F-+H2O
HF+NH3·H2O,玻璃中的二氧化硅能溶于HF,其反应为:4HF+SiO2═SiF4↑+2H2O,故答案为:F-+H2O![]() HF+OH-或NH4++F-+H2O
HF+OH-或NH4++F-+H2O![]() HF+NH3·H2O;
HF+NH3·H2O;
(5)①0.1mol/L CH3COONH4溶液呈中性,说明铵根离子的水解程度与醋酸根离子的水解程度相同,即氨水和CH3COOH的电离程度相同,因为醋酸的酸性比碳酸的强,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,溶液显碱性,故答案为:碱;
②等体积0.4mol/L CH3COOH溶液和0.2mol/L NaOH溶液的混合液中含有等浓度的醋酸钠和醋酸,因为溶液显酸性,说明醋酸的电离程度大于醋酸根的水解程度,因此除H2O外所有分子、离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-);
③ A. 0.1mol/L CH3COONH4溶液显中性,但铵根离子和醋酸根离子均水解促进水的电离;B. 0.1mol/L CH3COOH溶液,为酸,抑制水的电离;C.0.1mol/L CH3COONa溶液水解显碱性,促进水的电离,但促进程度比A小;D.等体积0.4mol/L CH3COOH溶液和0.2mol/L NaOH溶液的混合液含有浓度均为0.1mol/L的醋酸钠和醋酸,因为溶液显酸性,说明醋酸的电离程度大于醋酸根的水解程度,抑制水的电离,但抑制程度比B小,上述四种溶液中水的电离程度由小到大的顺序为B<D<C<A,故答案为:B<D<C<A。


科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A. △H1>0,△H3<0
B. △H2>0,△H4>0
C. △H1=△H2+△H3
D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素,如图是实验室从海藻中提取捵的部分流程:
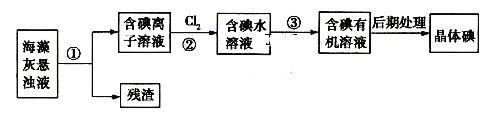
下列判断不正确的是
A.步骤①、③的操作分别是过滤、萃取分液
B.步骤②中反应的离子方程式为:![]()
C.可用淀粉溶液检验步骤②中的反应是否进行完全
D.步骤③中加入的有机溶剂可以是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型如图:
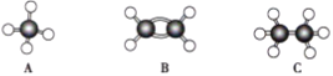
(1).等质量的以上物质完全燃烧时耗去O2的量最多的是______(填对应字母,下同)
(2).同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是______
(3).等质量的以上三种物质燃烧时,生成水最多的是______
(4).在120℃、1.01×105Pa条件下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-硫电池具有高能量密度、续航能力强等特点。使用新型碳材料复合型硫电极的锂-硫电池工作原理示意图如图,下列说法正确的是
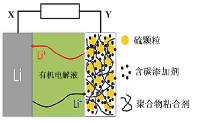
A.电池放电时,X电极发生还原反应
B.电池充电时,Y电极接电源正极
C.电池放电时,电子由锂电极经有机电解液介质流向硫电极
D.向电解液中添加Li2SO4水溶液,可增强导电性,改善性能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来将氯化氢转化为氯气的技术成为科学研究的热点。
(1)迪肯发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为密闭容器中, 进料浓度比 c(HCl) ∶c(O2)分别等于 1∶1、4∶1、7∶1 时 HCl 平衡转化率随温度 变化的关系:
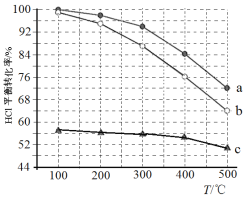
①据图像可知反应平衡常数 K(300℃)______K(400℃),(填“>”或“<”)。判 断理由是:________________________________________________;
②若进料浓度比 c(HCl) ∶c(O2)等于 1∶1,400℃时,O2 的转化率是______。
(2)Deacon 直接氧化法可按下列催化过程进行:CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH1=-20 kJ·mol-1,CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH2=-121 kJ·mol-1,4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
若是利用ΔH1和ΔH2计算ΔH3时,还需要利用__________反应的ΔH。
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计 了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
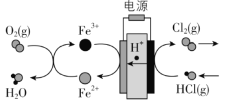
阴极区发生的反应有Fe3+ + e- = Fe2+和___________________(写反应方程式)。
电路中转移1 mol电子,可生成氯气__________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或化学方程式正确的是
A.用CuSO4溶液除去乙炔中的H2S:S2-+ Cu2+ = CuS ↓
B.某种火箭发射逸出的N2O4变红棕色:N2O4 ![]() 2NO2
2NO2
C.Na2O2用于呼吸面具供氧:Na2O2+H2O = 2NaOH+O2↑
D.CuSO4溶液中加入过量氨水:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着化工产业的迅猛发展,氯化氢转化为氯气的技术成为科学研究的热点。请按要求回答下列问题:
(1)HCl直接氧化法制Cl2可按下列催化过程进行:
CuCl2(s)=CuCl(s)+1/2Cl2(g) ΔH1 = +83 kJ·mol-1
CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH2 = -20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3 = -121 kJ·mol-1
写出HCl直接氧化法制Cl2的热化学方程式:____________________________。
(2)在恒定容器中用上述HCl直接氧化法制Cl2,进料c(HCl) ∶c(O2)分别为1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如下图所示:
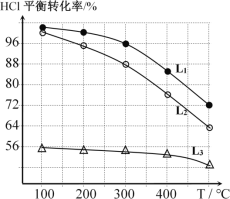
①判断图中c(HCl) /c(O2) = 1:1的曲线为________。
②按化学计量系数比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料时c(HCl)/c(O2)过低、过高的不利影响分别是____________、________。
③综合上述信息,写出在一定温度的条件下进一步提高HCl的转化率的方法: ________________________________________。
④观察上图,以任何一条曲线为例,平衡常数K(200℃)________K(300℃)(填“大于”、“小于”或“等于”)。
⑤设O2初始浓度为c,计算L2对应K(300℃) =____________(列出含c的计算式)。
(3)科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
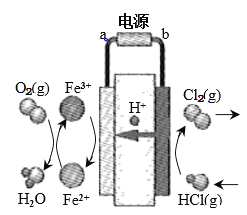
①电源b极为____________极。
②写出阳极区域反应方程式:________________________________________。
③电路中转移1 mol电子时,阳极产生气体体积为__________________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下:
i. SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+SO2=SO![]() +4H++2I-
+4H++2I-
序号 | ① | ② | ③ | ④ |
试剂 组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验 现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较①快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较①快 |
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中),下列说法不正确的是
A. 水溶液中SO2歧化反应方程式为:3SO2+2H2O =S↓+2H2SO4
B. ②是①的对比实验,则a=0.4
C. 比较①、②、③,可得出结论:I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可加快歧化反应速率
D. 实验表明,SO2的歧化反应速率④>①,原因是反应i比ii快,反应ii中产生的H+是反应i加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com