
����Ŀ����ͼ��ʾ����������̼�Ƿ�����ˮ����ʱ��������������Ʒ�Ӧ������������ͨ������ʵ�����֤����

(1)��ͼװ�ã��ڸ�����Թܢ���װ��Na2O2����ͨ��CO2֮ǰ��Ӧ���Ƚ�����(K1��K2)�رպã�Ŀ����____________
(2)�Թܢ��ڵ��Լ�X��________ʱ������K1��K2�������Թܢ�Լ5���Ӻ������ǵ�Сľ�������Թܢ��Һ���ϣ��ɹ۲쵽�����ǵ�Сľ�����ܾ��ҵ�ȼ���������Ң��ڵ���ɫ��ĩδ�����仯�������õĽ�����____________________
(3)�Թܢ����Լ�ΪCO2����ˮ��Һʱ����������ͬ(2)��ͨ��________��������֤��Na2O2�볱ʪ��CO2�ܷ�Ӧ�ҷų�O2��
(4)д�� Na2O2��CO2��Ӧ�Ļ�ѧ����ʽ___________
���𰸡���ֹIII�еĹ������ƺ������ͨʱ�������� ŨH2SO4 �������ƺ���Ķ�����̼����Ӧ �����ǵ�Сľ�����Թ�II��Һ���ϸ�ȼ��III���ɵ���ɫ��� 2Na2O2+2CO2=2Na2CO3+O2
��������
(1) Na2O2����ˮ�Լ�CO2��Ӧ�������ڸ�����Թܢ���װ��Na2O2����ͨ��CO2֮ǰ��Ӧ���Ƚ�����(K1��K2)�رպá��ʴ�Ϊ����ֹIII�еĹ������ƺ������ͨʱ����������
(2) Ҫ֤����������̼�Ƿ�����ˮ����ʱ��������������Ʒ�Ӧ��������ͨ���Թܢ��CO2Ӧ���Ǹ���ģ������Թܢ���Ӧװ�и����Ũ���ᡣ���������ƺ���Ķ�����̼������Ӧ���������������ʹ�����ǵ�Сľ����ȼ��ͬʱ���ɰ�ɫ����̼���ƣ����Ԣ��ڵ���ɫ��ĩ���ף�ʵ���й۲쵽�����ǵ�Сľ�����ܾ��ҵ�ȼ���������Ң��ڵ���ɫ��ĩδ�����仯��˵���������ƺ���Ķ�����̼����Ӧ���ʴ�Ϊ��ŨH2SO4���������ƺ���Ķ�����̼����Ӧ��
(3) ��Na2O2�볱ʪ��CO2�ܷ�Ӧ��������̼���ƺ�O2��������ʹ�����ǵ�Сľ����ȼ���Թܢ��й����ɵ���ɫ��ס��ʴ�Ϊ�������ǵ�Сľ�����Թ�II��Һ���ϸ�ȼ��III���ɵ���ɫ��ס�
(4) Na2O2��CO2��Ӧ�Ļ�ѧ����ʽΪ2Na2O2+2CO2=2Na2CO3+O2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����(����)
A. п��CH3COOH��Һ��Ӧ��Zn��2H��===Zn2����H2��
B. ����������ϡ���ᷴӦ��H����OH��===H2O
C. CuCl2��Һ�����۷�Ӧ��3Cu2����2Fe===3Cu��2Fe3��
D. MgCl2��Һ�백ˮ��Ӧ��Mg2����2NH3��H2O===Mg(OH)2����2NH![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PCl3��PCl5������Ҫ�Ļ���ԭ�ϣ���PCl3��g����Cl2��g��������������2L�ܱ������У���һ�������·���������Ӧ������10minʱ�ﵽƽ�⣺PCl3��g��+Cl2��g��![]() PCl5��g�� ��H��0���й��������£�
PCl5��g�� ��H��0���й��������£�
PCl3��g�� | Cl2��g�� | PCl5��g�� | |
��ʼŨ�ȣ�mol/L�� | 2.0 | 1.0 | 0 |
ƽ��Ũ�ȣ�mol/L�� | c1 | c2 | 0.4 |
�����жϲ���ȷ����
A. 10 min�ڣ�v��Cl2��=0.04 mol/��Lmin��
B. ��������Cl2Ϊ1.2 molʱ����Ӧ�ﵽƽ��
C. �����¶ȣ���Ӧ��ƽ�ⳣ������ƽ��ʱPCl3�����ʵ���Ũ�ȣ�1.6mol/L
D. ƽ�������2.0 mol PCl3��1.0 molCl2������ͬ�������ٴ�ƽ��ʱ��c��PCl5����0.2 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǻ���ɫ��ǿ�Ҵ̼�����ζ�ľ綾���壬����Ҫ�Ĺ�ҵԭ�ϡ��ش��������⣺
��1��������ȥ�����㲢����ֽ����ú�ͣ���ʯ�����������ۻ���������ʢ�������ļ���ƿ���������Ϸ���������____________���÷�Ӧ�з�Ӧ�������______________������ڡ����ڡ����������������
��2����ʢ��KI��Һ���Թ��м�������CCl4��μ����Ƶ���ˮ�����ã�CCl4�����Ϻ�ɫ�������ӷ���ʽ���ͣ�____________________________________________________��
��3��������Cl2����CH4��Ӧ��д������һ�ȼ���Ļ�ѧ����ʽ��___________________��ʵ����������ͼ��ʾ��װ�ý��м����������ڹ����·�Ӧ��ʵ�顣

�����·�Ӧһ��ʱ�������װ��ʾ��ͼ������ȷ��ӳʵ���������_________�����ţ���
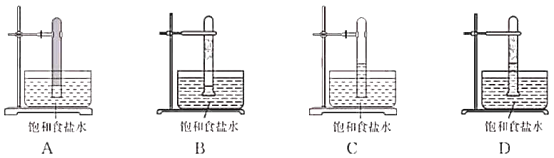
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУѧ������С��Ϊ�ⶨ��Ԫ�ص����ԭ����������Ƶ�װ����ͼ��ʾ����װ��(����ˮ�����)��������Ϊag����ʵ����ȡ��bg(������)�Ʒ���ˮ�У�����ƿ������ȫ��Ӧ���ٳ�����װ�õ�������Ϊcg���Իش�

(1)ʵ����ȡ��һС���ƣ���Ҫ�õ�__________________ʵ��������
(2)�˸���ܵ�������________________________�������ƿ��м����������������������ԭ���������ʵ�����ԭ������________(�ƫ����ƫС�����䡱)��
(3)�м�ͬѧ������ͼ�и����������һͬ������ܣ���Ŀ����____________________�������Ƶ����ԭ�������ı���ʽΪ____________________��
(4)����ͬѧΪ���������ж�����Ѹ�ٲ���ƫ��ֽ����ڼ���ƿ���ټ���һ����ú�ͣ���Ŀ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���ij�ܱ������н������·�Ӧ��

mA(g)��nB(g)![]() pC(g)��qD(g)��������ѹǿ�������¶ȣ����´ﵽƽ�⣬
pC(g)��qD(g)��������ѹǿ�������¶ȣ����´ﵽƽ�⣬
��Ӧ������ʱ��ı仯������ͼ��ʾ����Ը÷�Ӧ��������ȷ����( )
A. ����Ӧ�����ȷ�Ӧ B. �淴Ӧ�Ƿ��ȷ�Ӧ
C. m��n<p��q D. m��n>p��q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NH3��HCl��������������Ȫʵ������壬������ͬ�������õ������ƿ���ռ���NH3��HCl���壬������ͼ��ʾʵ��(����ƿ�ڳ�����Һ�Ҳ��������ʵ���ɢ)������˵���������
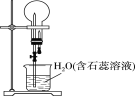
A. NH3��HCl�ֱ��γ���ɫ����ɫ��Ȫ
B. �Ʊ������NH3��HCl������ĸ�����ֱ��Ǽ�ʯ�ҡ�Ũ����
C. ����ƿ�и�ΪNO2����������Һ���ʵ����ʵ���Ũ����ǰ���߲�ͬ
D. ȥ��װ���еĽ�ͷ�ιܣ���Ϊ��������Ҳ��������Ȫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˲ⶨ��ͭ��ͭ��п�Ͻ���ͭ������������ȡ20g��ͭ��Ʒ������ձ��У���200gϡ������Ĵμ��룬ʵ�������������±���
ʵ����� | ��һ�� | �ڶ��� | ������ | ���Ĵ� |
����ϡ��������/g | 50 | 50 | 50 | 50 |
ʣ����������/g | 16.75 | 13.5 | m | 12.2 |
���㣺
��1������m=______��
��2����ͭ��Ʒ��ͭ����������Ϊ���٣���д��������̣�______
��3����Ӧ�ܹ�������������ʵ����Ƕ��٣���д��������̣�_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��̽��С���о�320 KʱN2O5�ķֽⷴӦ��2N2O5![]() 4NO2��O2����ͼ�Ǹ�С��������������е�ʵ�����ݻ��Ƶġ������й�˵����ȷ����
4NO2��O2����ͼ�Ǹ�С��������������е�ʵ�����ݻ��Ƶġ������й�˵����ȷ����
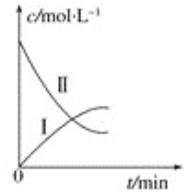
t/min | 0 | 1 | 2 | 3 | 4 |
c(N2O5)/mol/L | 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
c(O2)/mol/L | 0 | 0.023 | 0.040 | 0.052 | 0.060 |
A.���ߢ���N2O5��Ũ�ȱ仯����
B.���ߢ���O2��Ũ�ȱ仯����
C.N2O5��Ũ��Խ��Ӧ����Խ��
D.�����¶ȶԸ÷�Ӧ������Ӱ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com