
【题目】(1)如图某有机物的结构简式为:
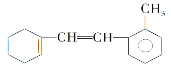
①1mol该物质和溴水反应,消耗Br2的物质的量为__mol;
②该物质与足量氢气完全加成后环上的一氯代物有__种;
(2)现有六种有机物,请回答下列问题:
A.![]() B.
B.![]() C.
C.![]() D.
D.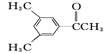 E.
E.![]() F.
F.![]()
①上述化合物中互为同分异构体的是__;互为同系物的是__。
②A物质中含有的官能团名称为__。
③D的一氯代物最多有__种。
【答案】2 10 A和C B和F 碳碳双键;羟基 4
【解析】
(1)①1mol该物质含有2mol碳碳双键,碳碳双键能够与溴发生加成,则1mol该物质与溴水反应,消耗2molBr2;
②该物质与足量的H2反应,碳碳双键和苯环与氢气发生加成,该分子环上有10种氢原子,如图所示, ,则其环上的一氯代物有10种;
,则其环上的一氯代物有10种;
(2)①同分异构体具有相同的分子式,不同的结构,A和C的分子式均为C9H10O,结构不同,是同分异构体;同系物,结构相似,分子相差若干个CH2,B和F,-OH均与苯环相连,均为酚类,分子式相差3个CH2,,B和F是同系物;
②A含有的官能团的名称为碳碳双键和羟基;
③D的分子中的苯环是对称的,分子中有4种H原子,因此D的一氯代物有4种。


科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
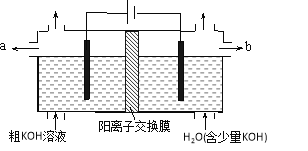
A. 通电后阴极区附近溶液pH会增大
B. 阳极反应式为4OH--4e-=2H2O+O2↑
C. 纯净的KOH溶液从b出口导出
D. K+通过交换膜从阴极区移向阳极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以铜铁矿(主要成分为CuO和Fe3O4,还含少量SiO2等杂质)为原料,冶炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下
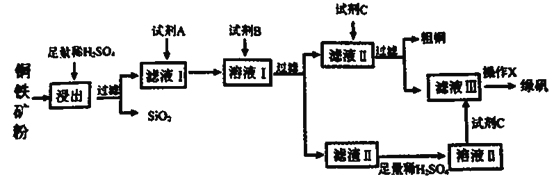
已知:滤渣II的主要成分为Fe(OH)3。请回答下列问题:
(1)如何提高黄铜矿的浸出率___________、___________?(至少答两种方法)
(2)试剂A为___________,其反应的离子方程式为_____________。
(3)试剂B不可能是
A.NH3·H2O B.CuO C.NaOH D.Cu2(OH)2CO3
(4)溶液II中溶质的成分为_______________。
(5)操作X的步骤是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是三种气态物质,在一定温度下其变化符合下图。下列说法一定正确的是( )
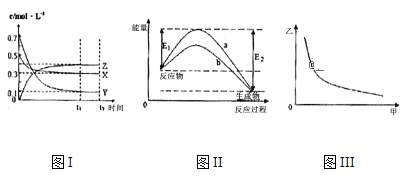
A.该反应的热化学方程式为X(g) +3Y(g) 2Z(g) △H= -(E2-E1)kJ
B.若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线
C.该温度下,反应的平衡常数数值约为533,若升高温度,该反应的平衡常数减小,Y的转化率降低
D.图II中曲线b是加入催化剂时的能量变化曲线,曲线a是没有加入催化剂时的能量变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-x FexPO4,其原理如图所示,下列说法正确的是( )
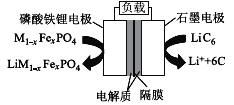
A.放电时,电流由石墨电极流向磷酸铁锂电极
B.电池总反应为M1-xFexPO4+LiC6![]() Li M1-xFexPO4+6C
Li M1-xFexPO4+6C
C.放电时,负极反应式为LiC6-e-=Li++6C
D.充电时,Li+移向磷酸铁锂电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用原电池原理,在室温下从含低浓度铜的酸性废水中回收铜的实验装置如图所示,下列说法错误的是
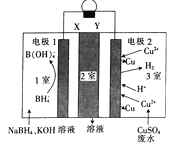
A. X、Y依次为阳离子、阴离子选择性交换膜
B. 负极的电极反应式:BH4-+8OH-一8e-═B(OH)4-+4H2O
C. 2室流出的溶液中溶质为Na2SO4和K2SO4
D. 电路中每转移1mol电子,电极2上有32gCu析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca3N2是重要的化学试剂,易潮解、被氧化,实验室用N2和金属钙在加热条件下制备Ca3N2的装置如图所示(已知:钙能在CO2中燃烧)。请回答下列问题:
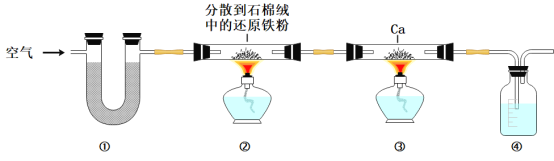
(1)Ca3N2中所含化学键的类型为____________。
A.离子键 B.共价键 C.氢键
(2)装置①中的U型管中的物质为___________,其作用为________________。
(3)装置②的作用为___________________________。
(4)组装好仪器,装入药品,通入空气后,应先点燃____________处酒精灯,再点燃另一个酒精灯。
(5)写出Ca3N2潮解时的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)室温下,使用pH计测定0.1mol/L NH4Cl溶液的pH=5.12.由此可以得到的结论是_____________(填字母).
a、溶液中c(H+)>c(OH) b、NH4+水解是微弱的
c、NH3H2O是弱碱 d、由H2O电离出的c(H+)<107mol/L
e、物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(2)室温下,用0.1mol/LNaOH溶液分别滴定20.00mL0.1mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是

①表示滴定盐酸的曲线是____________(填序号).
②滴定醋酸溶液的过程中:
i、V(NaOH)=10.00mL时,溶液中离子浓度由大到小的顺序为________________________.
ii、当c(Na+)=c(CH3COO)+c(CH3COOH)时,溶液pH________7(填“>”、“=”或“<”).
Ⅱ.复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1molL1的下列6种溶液的pH值:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是______(填编号).
A.CO2+H2O+2NaClO═Na2CO3+2HClO
B.CO2+H2O+NaClO═NaHCO3+HClO
C.CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
F.CH3COOH+NaCN═CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05molL1的下列5种物质的溶液中,pH最小的是______(填编号),其pH值为______(填数值);pH最大的是______(填编号).
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )
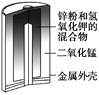
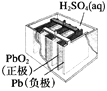
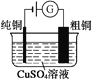
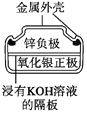
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A. 图1所示电池中,MnO2的作用是催化剂
B. 图2所示电池放电过程中,硫酸浓度不断增大
C. 图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com