
【题目】Ⅰ.(1)室温下,使用pH计测定0.1mol/L NH4Cl溶液的pH=5.12.由此可以得到的结论是_____________(填字母).
a、溶液中c(H+)>c(OH) b、NH4+水解是微弱的
c、NH3H2O是弱碱 d、由H2O电离出的c(H+)<107mol/L
e、物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(2)室温下,用0.1mol/LNaOH溶液分别滴定20.00mL0.1mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是

①表示滴定盐酸的曲线是____________(填序号).
②滴定醋酸溶液的过程中:
i、V(NaOH)=10.00mL时,溶液中离子浓度由大到小的顺序为________________________.
ii、当c(Na+)=c(CH3COO)+c(CH3COOH)时,溶液pH________7(填“>”、“=”或“<”).
Ⅱ.复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1molL1的下列6种溶液的pH值:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是______(填编号).
A.CO2+H2O+2NaClO═Na2CO3+2HClO
B.CO2+H2O+NaClO═NaHCO3+HClO
C.CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
F.CH3COOH+NaCN═CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05molL1的下列5种物质的溶液中,pH最小的是______(填编号),其pH值为______(填数值);pH最大的是______(填编号).
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
【答案】abc II c(CH3COO-)> c(Na+)> c(H+)>c(OH-) > AD ⑤ 1 ①
【解析】
Ⅰ.(1)室温下,使用pH计测定0.1mol/L NH4Cl溶液的pH=5.12,即溶液显酸性,说明NH4Cl为强酸弱碱盐,即NH3H2O是弱碱,据此分析;
(2)①醋酸为弱电解质,HCl是强电解质,相同浓度的醋酸和HCl溶液,醋酸的pH>盐酸的pH;
②i、V(NaOH)=10.00mL时,醋酸溶液中的溶质为等物质的量浓度的CH3COOH、CH3COONa,醋酸电离程度大于醋酸根离子的水解程度,溶液呈酸性,再结合电荷守恒判断;
ii、当c(Na+)=c(CH3COO)+c(CH3COOH)时,根据物料守恒可知,加入的NaOH溶液的物质的量与醋酸的物质的量相同,据此分析;
Ⅱ.(1)根据强酸制弱酸的规律进行分析;
(2)浓度均为0.05molL1的下列5种物质的溶液中,H+的浓度越大,pH越小,反之则越大,强酸的电离程度大于弱酸的电离程度。
Ⅰ.(1)室温下,使用pH计测定0.1mol/L NH4Cl溶液的pH=5.12,即溶液显酸性,说明NH4Cl为强酸弱碱盐,即NH3H2O是弱碱;
a. 溶液的pH=5.12,显酸性,因此溶液中c(H+)>c(OH),a项正确;
b.NH3H2O是弱碱,NH4+是弱碱的阳离子,在水溶液中可水解,但水解是微弱的,b项正确;
c. NH4Cl溶液显酸性,说明NH4Cl为强酸弱碱盐,即NH3H2O是弱碱,c项正确;
d. NH4Cl溶液显酸性,NH4+在水溶液中可水解,而盐的水解促进了水的电离,因此由H2O电离出的c(H+)>107mol/L,d项错误;
e、物质的量浓度相等的氨水和盐酸等体积混合,恰好完全反应得到NH4Cl溶液,溶液显酸性,因此溶液pH<7,e项错误;
正确的选abc;
(2)①醋酸为弱电解质,HCl是强电解质,相同浓度的醋酸和HCl溶液,醋酸的pH>盐酸的pH,所以I是滴定醋酸的曲线,II表示的是盐酸的曲线;
②i、V(NaOH)=10.00mL时,醋酸溶液中的溶质为等物质的量浓度的CH3COOH、CH3COONa,醋酸电离程度大于醋酸根离子的水解程度,溶液呈酸性,则c(H+)>c(OH-),再结合电荷守恒得c(Na+)<c(CH3COO-),故离子浓度的大小关系为:c(CH3COO-)> c(Na+)> c(H+)>c(OH-);
ii、当c(Na+)=c(CH3COO)+c(CH3COOH)时,根据物料守恒知,加入的NaOH溶液的物质的量与醋酸的物质的量相同,此时两者恰好完全反应得醋酸钠溶液,而醋酸钠为强碱弱酸盐,水解显碱性,溶液的pH>7;
Ⅱ.(1)相同浓度的钠盐溶液,酸根水解程度越大,则钠盐溶液的pH越大,酸的酸性越小,根据钠盐溶液的pH可知,酸性强弱顺序为:CH3COOH>H2CO3>HClO>HCN>C6H5OH,根据强酸制弱酸判断:
A. 酸性H2CO3>HClO>HCO3- ,因此反应生成碳酸氢钠,而不是碳酸钠,A项错误;
B. 酸性H2CO3>HClO>HCO3- ,因此反应生成碳酸氢钠,反应为:CO2+H2O+NaClO═NaHCO3+HClO,B项正确;
C. 酸性H2CO3> C6H5OH >HCO3- ,因此反应生成碳酸氢钠,方程式为:CO2+H2O+C6H5ONa→NaHCO3+C6H5OH,C项正确;
D. 酸性H2CO3> C6H5OH >HCO3- ,因此反应生成碳酸氢钠,而不是碳酸钠,D项错误;
E. 酸性H2CO3> C6H5OH >HCO3- ,反应生成碳酸氢钠,方程式为:Na2CO3+C6H5OH→NaHCO3+C6H5ONa,E项正确;
F.酸性CH3COOH >HCN,所以 CH3COOH+NaCN═CH3COONa+HCN可以发生,F项正确;
不能成立的是AD;
(2)浓度均为0.05molL1的下列5种物质的溶液中,只有硫酸为二元酸,电离出的H+浓度最大,因此酸性最强,pH最小,浓度为0.05molL1的硫酸中,c(H+)=0.1molL1,因此pH=1,根据表格中的数据可知HCN得酸性最弱,电离程度最小,因此H+的浓度最小,即pH最大。


科目:高中化学 来源: 题型:
【题目】CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1) 图1是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH________0(填“>”“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图2所示。则该反应的平衡常数为______________。

③若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2) 在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________℃;该温度下上述反应的化学平衡常数为________。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图某有机物的结构简式为:
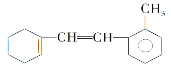
①1mol该物质和溴水反应,消耗Br2的物质的量为__mol;
②该物质与足量氢气完全加成后环上的一氯代物有__种;
(2)现有六种有机物,请回答下列问题:
A.![]() B.
B.![]() C.
C.![]() D.
D.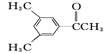 E.
E.![]() F.
F.![]()
①上述化合物中互为同分异构体的是__;互为同系物的是__。
②A物质中含有的官能团名称为__。
③D的一氯代物最多有__种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000 mol/L的盐酸滴定20.00 mL NaOH溶液,测定其浓度,下列说法正确的是
A.需用NaOH溶液润洗锥形瓶
B.用量筒量取20.00 mL NaOH溶液
C.使用酚酞做指示剂,滴定终点的现象为溶液浅红色褪去,半分钟不变色
D.滴定前,没有除去酸式滴定管中的气泡,滴定后气泡消失,所测浓度会偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
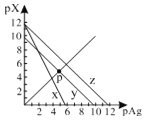
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④Al2(SO4)3 ⑤CH3COOH ⑥NaHCO3。
(1)25℃时,0.1mol·L-1②溶液的pH________7(填“>”、“=”或“<”);其原因是______________________________________(用离子方程式表示);
(2)常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类________(填“相同”或是“不相同”);
(3)将④溶液加热蒸干并灼烧最终得到的物质是____________(填化学式);
(4)常温下0.1 mol/L的⑤溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定烟雾中的SO2含量,可做下列实验:取100 L该烟雾(标准状况),通过盛放100 mL过氧化氢(H2O2)水溶液的吸收瓶,使它们充分反应,生成硫酸。在吸收后的水溶液中加入BaCl2溶液,生成白色沉淀,经测定其质量为11.65 g,则该烟雾中SO2的体积分数是( )
A. 1.12% B. 2.24%
C. 3.36% D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列化学平衡在一定条件下发生移动的描述,不正确的是
A. Cl2+H2O![]() HCl+HClO,氯水中加入碳酸钙,漂白性增强
HCl+HClO,氯水中加入碳酸钙,漂白性增强
B. ZnS + Cu2+![]() CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
C. 2NO2![]() N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
D. Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种碱性阴离子交换膜燃料电池的工作原理如下图所示。若以甲醇为燃料,空气为助燃气,下列说法正确的是( )
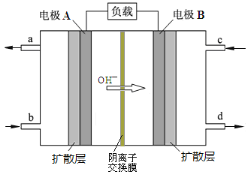
A.电极A为该电池的负极,工作时电子由电极A经负载流向电极B
B.电极B上发生的电极反应为:O2+2H2O+4e-===4OH-
C.电路中每通过6 mol电子,理论上需要消耗32 g甲醇
D.该电池工作时的总反应式为:2CH3OH+3O2===2CO2+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com