
【题目】某种碱性阴离子交换膜燃料电池的工作原理如下图所示。若以甲醇为燃料,空气为助燃气,下列说法正确的是( )
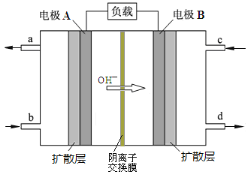
A.电极A为该电池的负极,工作时电子由电极A经负载流向电极B
B.电极B上发生的电极反应为:O2+2H2O+4e-===4OH-
C.电路中每通过6 mol电子,理论上需要消耗32 g甲醇
D.该电池工作时的总反应式为:2CH3OH+3O2===2CO2+4H2O
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)室温下,使用pH计测定0.1mol/L NH4Cl溶液的pH=5.12.由此可以得到的结论是_____________(填字母).
a、溶液中c(H+)>c(OH) b、NH4+水解是微弱的
c、NH3H2O是弱碱 d、由H2O电离出的c(H+)<107mol/L
e、物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(2)室温下,用0.1mol/LNaOH溶液分别滴定20.00mL0.1mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是

①表示滴定盐酸的曲线是____________(填序号).
②滴定醋酸溶液的过程中:
i、V(NaOH)=10.00mL时,溶液中离子浓度由大到小的顺序为________________________.
ii、当c(Na+)=c(CH3COO)+c(CH3COOH)时,溶液pH________7(填“>”、“=”或“<”).
Ⅱ.复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1molL1的下列6种溶液的pH值:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是______(填编号).
A.CO2+H2O+2NaClO═Na2CO3+2HClO
B.CO2+H2O+NaClO═NaHCO3+HClO
C.CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
F.CH3COOH+NaCN═CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05molL1的下列5种物质的溶液中,pH最小的是______(填编号),其pH值为______(填数值);pH最大的是______(填编号).
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )
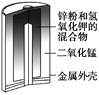
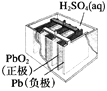
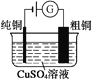
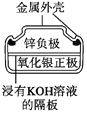
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A. 图1所示电池中,MnO2的作用是催化剂
B. 图2所示电池放电过程中,硫酸浓度不断增大
C. 图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中存在两种含氧官能团
B. 1mol该有机物可以分别与3molBr2和5molH2发生加成反应
C. 该有机物可以使溴水和酸性高锰酸钾溶液均褪色
D. 该有机物可以发生氧化反应、加成反应、取代反应和水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池具有成本低、能量转换效率高、寿命长等优点。一种钠离子电池用碳基材料 (NamCn)作负极,利用钠离子在正负极之间嵌脱过程实现充放电,该钠离子电池的工作原理 为Na1-mCoO2+NamCn![]() NaCoO2+Cn。下列说法不正确的是
NaCoO2+Cn。下列说法不正确的是
A.放电时,Na+向正极移动
B.放电时,负极的电极反应式为NamCn—me-=mNa++Cn
C.充电时,阴极质量减小
D.充电时,阳极的电极反应式为NaCoO2-me-=Na1-mCoO2+mNa+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向氨水中加入盐酸至中性,溶液中![]() <1
<1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如图所示:
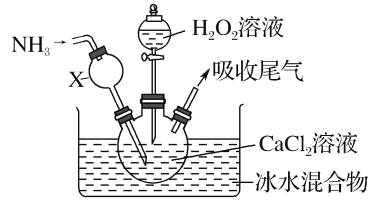
回答下列问题:
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有___。
(2)仪器X的主要作用除导气外,还具有的作用是___。
(3)在冰水浴中进行的原因是___。
(4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为___。
(5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是____。
A.无水乙醇 B.浓盐酸 C.Na2SO3溶液 D.CaCl2溶液
(6)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为:
①Fe3+ +H2O2=Fe2++H++HOO·
②H2O2+X=Y +Z+W(已配平)
③Fe2++·OH=Fe3++OH-
④H+ +OH-=H2O
根据上述机理推导步骤②中的化学方程式为___。
(7)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙具有____的性质。
A.与水缓慢反应供氧 B.能吸收鱼苗呼出的CO2气体
C.能是水体酸性增强 D.具有强氧化性,可杀菌灭藻
(8)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。
该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。
则:所得过氧化钙样品中CaO2的纯度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>CB. 原子序数:d>c>b>a
C. 离子半径:C>D>B>AD. 单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含![]() 明矾的溶液中加入含
明矾的溶液中加入含![]() 的溶液,下列说法正确的是
的溶液,下列说法正确的是![]()
![]()
A.该过程中先产生白色沉淀,后沉淀部分溶解,质量减少
B.当![]() 时,发生
时,发生![]()
C.当![]() 时,溶液中
时,溶液中![]() :
:![]() :
:![]()
D.当![]() 时,所得沉淀的物质的量达最大值
时,所得沉淀的物质的量达最大值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com