
【题目】向含![]() 明矾的溶液中加入含
明矾的溶液中加入含![]() 的溶液,下列说法正确的是
的溶液,下列说法正确的是![]()
![]()
A.该过程中先产生白色沉淀,后沉淀部分溶解,质量减少
B.当![]() 时,发生
时,发生![]()
C.当![]() 时,溶液中
时,溶液中![]() :
:![]() :
:![]()
D.当![]() 时,所得沉淀的物质的量达最大值
时,所得沉淀的物质的量达最大值
【答案】D
【解析】
amol明矾的溶液中逐滴加入![]() 溶液,涉及反应①
溶液,涉及反应①![]() ;②
;②![]() ;整个反应过程可分三个阶段:
;整个反应过程可分三个阶段:
第一阶段:从开始滴入![]() 到
到![]() 时,反应按
时,反应按![]() 进行,溶液中的
进行,溶液中的![]() 、
、![]() 、
、![]() 、
、![]() 离子均转化成沉淀;
离子均转化成沉淀;
第二阶段:当滴入![]() 从
从![]() 到2amol之间时,
到2amol之间时,![]() 继续与
继续与![]() 反应生成
反应生成![]() ,同时①反应生成的
,同时①反应生成的![]() 沉淀与
沉淀与![]() 反应溶解,生成
反应溶解,生成![]() ;
;
第三阶段:当滴入到![]() 时,按②进行,生成的
时,按②进行,生成的![]() 全部转化为
全部转化为![]() ,共生成2amolBaSO4;
,共生成2amolBaSO4;
A.当向含amol明矾的溶液中加入含bmolBa(OH)2的溶液时,先发生2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓,后发生SO42-+Ba2++2Al(OH)3+2OH-=BaSO4↓+2AlO2-,该过程中先产生白色沉淀,后沉淀Al(OH)3溶解但又生成沉淀BaSO4,质量依然增大,故A错误;
B.当3a>2b时,明矾过量,Ba(OH)2中钡离子、氢氧根离子完全沉淀,发生离子反应为:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓,故B错误;
C.当a<2b<4a时,溶液中所以硫酸根的物质的量为2a-b,AlO2-的物质的量即沉淀铝离子后剩余的氢氧根离子的物质的量为2b-3a,所以溶液中c(AlO2-):c(SO42-)=(2b-3a):(2a-b),故C错误;
D.当3a=2b时,Ba(OH)2中钡离子、氢氧根离子完全沉淀,这时所得沉淀的物质的量达最大值,故D正确;
故选:D。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某种碱性阴离子交换膜燃料电池的工作原理如下图所示。若以甲醇为燃料,空气为助燃气,下列说法正确的是( )
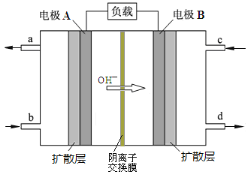
A.电极A为该电池的负极,工作时电子由电极A经负载流向电极B
B.电极B上发生的电极反应为:O2+2H2O+4e-===4OH-
C.电路中每通过6 mol电子,理论上需要消耗32 g甲醇
D.该电池工作时的总反应式为:2CH3OH+3O2===2CO2+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、氮的氧化物是形成酸雨的主要原因,一种比较常用的方法是用NH3处理氮的氧化物(NxOy)。完成下列问题。
(1)已知:①2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1253.4kJ/mol
则用NH3处理NO生成氮气和气态水的热化学方程式为__。
(2)已知:N2(g)+3H2(g)![]() 2NH3(g) △H<0。不同温度下,向三个一样的容器中投入相同的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
2NH3(g) △H<0。不同温度下,向三个一样的容器中投入相同的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。

①M点的v正__Q点的v正(填“>”“<”或“=”),原因是__。
②维持10MPa、T3℃的条件不变,要提高H2的转化率,可以采取的措施是__(任写一条)。
③图中三条曲线对应的温度T1、T2、T3由高到低的顺序为___。
④恒温恒容条件下,能说明反应N2(g)+3H2(g)![]() 2NH3(g)达到平衡状态的是__(填选项字母)
2NH3(g)达到平衡状态的是__(填选项字母)
A.![]() 保持不变
保持不变
B.3molH-H键断裂的同时,有2molN-H键断裂
C.2v(N2)=v(NH3)
D.反应器中的压强不再发生变化
⑤T3温度下,将1molN2和3molH2充入2L的恒容密闭容器中反应,一段时间后达到N点的平衡状态,则反应的平衡常数为K=__(结果保留2位小数),M点与Q点对应的平衡常数大小关系为M__Q(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量相等的硫酸铝和硫酸铵溶于水形成VmL混合溶液,向混合溶液中逐滴加入某氢氧化钠溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量.下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铝粉和四氧化三铁粉配成铝热剂,分成两等份。一份在高温下恰好完全反应后,再与足量盐酸起反应;另一份放入足量的烧碱溶液中充分反应;前后两种情况下生成的气体的质量比是
A.8:9B.2:3C.3:4D.4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、下图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前后盛放盐酸的滴定管中液面的位置。

实验编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的读数(mL) | 滴定后盐酸的读数(mL) |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 1.21 | 29.21 |
3 | 20.00 | 1.50 | 23.48 |
请回答下列问题:
(1)仪器A的名称是_________________。
(2)盐酸的体积读数:滴定前读数为___________,滴定后读数为_____________。
(3)某实验小组同学的三次实验的实验数据如上表所示。根据表中数据计算出待测NaOH溶液的平均溶度是____________mol/L(保留四位有效数字)。
(4)对下列几种假定情况进行讨论:
①取待测溶液的滴定管,放液前滴定管尖端有气泡,放液后气泡消失,对测定结果的影响是____________(填“无影响”“偏高”或“偏低”,下同)
②滴定前锥形瓶未用待测液润洗,对测定结果的影响是_______________;
Ⅱ、氧化还原滴定实验与酸碱中和滴定类似,原理是用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。现用0.001mol/L酸性KMnO4溶液滴定位置浓度的Na2SO3溶液,反应的离子方程式是2MnO4- + 5SO32- + 6H+=2Mn2+ + 5SO42- + 3H2O。请回答下列问题:
(1)该滴定实验所需仪器有________________。
A、酸式滴定管(50mL) B、碱式滴定管(50mL) C、量筒(10mL) D、锥形瓶 E、铁架台F、滴定管夹 G、烧杯 H、胶头滴管 I、漏斗
(2)实验时,应用_____________(填“酸式”或“碱式”,下同)滴定管盛放高锰酸钾溶液,应用__________滴定管盛放亚硫酸钠溶液。
(3)该实验_____________(填“需要”或“不需要”)加入指示剂,原因是_____________。滴定达到终点的标志是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线图(纵坐标为沉淀的量,横坐标为加入物的量)与对应选项不正确的是( )

A.向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液中加入0.1 mol/L稀H2SO4溶液
B.向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的1L混合液中加入0.1mol/L NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向Ca(OH)2溶液中逐渐通入二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是


A.图甲中纯水仅升高温度,就可以从a点变到c点
B.图甲中在b点对应温度下,将pH=2的H2SO4溶液与pH=10的NaOH溶液等体积混合后,溶液显中性
C.图乙表相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
D.图丙表示20oC时用0.100mol/L氢氧化钠溶液分别滴定20.00mL0.100mol/L的盐酸和醋酸,V(NaOH)=20.00mL时,两份溶液中c(Cl-)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
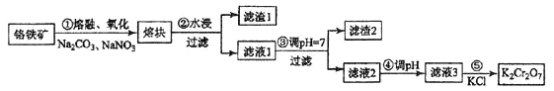
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com