
【题目】下列图示与对应的叙述相符的是


A.图甲中纯水仅升高温度,就可以从a点变到c点
B.图甲中在b点对应温度下,将pH=2的H2SO4溶液与pH=10的NaOH溶液等体积混合后,溶液显中性
C.图乙表相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
D.图丙表示20oC时用0.100mol/L氢氧化钠溶液分别滴定20.00mL0.100mol/L的盐酸和醋酸,V(NaOH)=20.00mL时,两份溶液中c(Cl-)=c(CH3COO-)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>CB. 原子序数:d>c>b>a
C. 离子半径:C>D>B>AD. 单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含![]() 明矾的溶液中加入含
明矾的溶液中加入含![]() 的溶液,下列说法正确的是
的溶液,下列说法正确的是![]()
![]()
A.该过程中先产生白色沉淀,后沉淀部分溶解,质量减少
B.当![]() 时,发生
时,发生![]()
C.当![]() 时,溶液中
时,溶液中![]() :
:![]() :
:![]()
D.当![]() 时,所得沉淀的物质的量达最大值
时,所得沉淀的物质的量达最大值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将2.0molA(g)和2.0molB(g)充入体积为1L的密闭容器中,在一定条件发生下述反应:A(g)+B(g)![]() 2C(g)+D(s)△H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
2C(g)+D(s)△H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
A. t时刻反应达到平衡时,A(g)的体积分数为20%
B. T℃时该反应的化学平衡常数Kc=2
C. t时刻反应达到平衡后,缩小容器体积,平衡逆向移动
D. 相同条件下,若将1.0molA(g)和1.0molB(g)充入同样容器,达到平衡后,A(g)的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中符合图像的是

A.2SO3(g) ![]() 2SO2(g)+O2(g) △H=+Q2kJ·mol-1(Q2>0)
2SO2(g)+O2(g) △H=+Q2kJ·mol-1(Q2>0)
B.H2(g)+CO(g) ![]() C(s)+H2O(g) △H=+Q4kJ·mol-1(Q4>0)
C(s)+H2O(g) △H=+Q4kJ·mol-1(Q4>0)
C.N2(g)+3H2(g) ![]() 2NH3(g) △H =-Q1kJ·mol-1 (Q1>0)
2NH3(g) △H =-Q1kJ·mol-1 (Q1>0)
D.4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H =-Q3kJ·mol-1 (Q3>0)
4NO(g)+6H2O(g) △H =-Q3kJ·mol-1 (Q3>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示从废旧普通锌锰电池内容物中回收制备KMnO4等物质的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
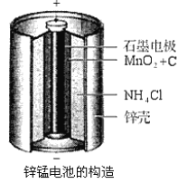
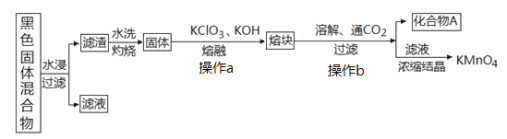
(1)KMnO4稀溶液是一种常用消毒剂,其消毒机理与下列物质相似的是______________(填序号)
A.双氧水B.75%酒精C.84消毒液(NaClO溶液)D.苯酚
(2)①黑色固体混合物水浸时为提高浸出速率,常采用的措施为_____________________(答出一条即可)。
②滤渣水洗灼烧后固体是一种黑色的化合物,操作a中得到熔块的主要成分是K2MnO4和KCl,该过程中发生反应的化学方程式为:_____________________________。
③图中产物A是一种难溶于水的黑色固体,常在有些反应中作催化剂,其化学式为:_________________。
(3)某实验小组用提纯后的KMnO4配置成0.1000mol/L溶液来测定某试样中过氧化氢的含量
①查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:_____。
②配制250mL0.100mol/L标准KMnO4溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒和、___________;
③滴定反应原理为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,该反应中H2O2体现___________(填“氧化性”、“还原性”、“酸性”);
④用0.100mol/L标准KMnO4溶液滴定含H2O2试样的溶液时,KMnO4溶液(酸化)放在_____滴定管中,并判断滴定至终点的现象是_____。
⑤用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的高锰酸钾体积如表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为___________mol/L。
⑥下列操作会引起测定结果偏高的是___________。
A.滴定管在盛装高锰酸钾前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.锥形瓶未用待测液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属混合物粉末15 g与足量的盐酸反应时生成标准状况下11.2 L氢气,符合上述情况的金属混合物
A.Mg、FeB.Zn、AgC.Zn、FeD.Mg、Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以空气中的氮气为原料制备硝酸,合成线路如图(反应条件及部分反应物、生成物已略去):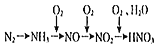 已知空气中含氮气的体积分数为78%,若用100 L(已折算成标准状况下)空气制备硝酸,则理论上可制得硝酸的量的计算式正确的是
已知空气中含氮气的体积分数为78%,若用100 L(已折算成标准状况下)空气制备硝酸,则理论上可制得硝酸的量的计算式正确的是
A.![]() B.
B.![]() mol
mol
C.![]() ×63 gD.2×100×78% L
×63 gD.2×100×78% L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸铝是一种不溶于水和醇,溶于强酸的白色粉末,是重要的媒染剂。某化学兴趣小组设计实验从废弃铝—空气海水电池中回收铝并制备草酸铝晶体。
【实验过程】
(一)铝的回收
①称取16.0g废弃电池原料;
②用98.3%的硫酸进行酸浸、稀释、除杂、过滤;
③将滤液蒸干得到硫酸铝固体mlg.
(二)草酸铝的制备
④配制250mL0.20mol/L的硫酸铝溶液;
⑤量取0.10mol/L的草酸铵溶液20.00mL,并加入一定量的分散剂,缓缓加入配制的硫酸铝溶液25.00mL,搅拌lh;
⑥沉化、抽滤、洗涤、干燥、称量固体质量为m2g。
【问题讨论】
(1)在用98.3%的硫酸进行酸浸时,浸出率与条件的关系如图所示:

由图可知浓硫酸为浸取剂的最佳条件为________。
(2)步骤③蒸干溶液所需的仪器有带铁圈的铁架台、酒精灯、_______、_______。
(3)铝的回收率为_______ (回收率=回收铝的质量/原料的质量)。
(4)步骤⑥中洗涤晶体时先用蒸馏水再用乙醇洗涤,这样洗涤的原因是_______。
(5)该研究小组在实验过程中发现,若用0.90mol/L草酸铵进行实验,会导致沉淀的质量远超过实际草酸铝的质量。经分析,结晶生成物为(NH4)xAly(C2O4)z·nH2O。 现称取3.990g该结晶水合物进行热分解,得到剩余固体的质量随温度变化的曲线如下图所示。己知450℃时剩余固体只有Al2O3。第II阶段共产生气体2.016L (标准状况),该气体通入足量的石灰水中产生3.000g沉淀。请计算求出该结晶水合物的化学式为______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com