
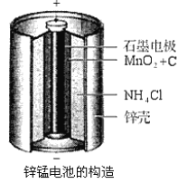
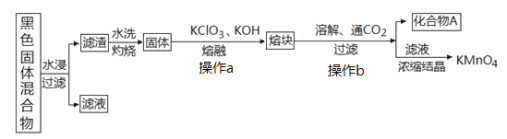
【题目】下图表示从废旧普通锌锰电池内容物中回收制备KMnO4等物质的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
(1)KMnO4稀溶液是一种常用消毒剂,其消毒机理与下列物质相似的是______________(填序号)
A.双氧水B.75%酒精C.84消毒液(NaClO溶液)D.苯酚
(2)①黑色固体混合物水浸时为提高浸出速率,常采用的措施为_____________________(答出一条即可)。
②滤渣水洗灼烧后固体是一种黑色的化合物,操作a中得到熔块的主要成分是K2MnO4和KCl,该过程中发生反应的化学方程式为:_____________________________。
③图中产物A是一种难溶于水的黑色固体,常在有些反应中作催化剂,其化学式为:_________________。
(3)某实验小组用提纯后的KMnO4配置成0.1000mol/L溶液来测定某试样中过氧化氢的含量
①查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:_____。
②配制250mL0.100mol/L标准KMnO4溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒和、___________;
③滴定反应原理为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,该反应中H2O2体现___________(填“氧化性”、“还原性”、“酸性”);
④用0.100mol/L标准KMnO4溶液滴定含H2O2试样的溶液时,KMnO4溶液(酸化)放在_____滴定管中,并判断滴定至终点的现象是_____。
⑤用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的高锰酸钾体积如表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为___________mol/L。
⑥下列操作会引起测定结果偏高的是___________。
A.滴定管在盛装高锰酸钾前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.锥形瓶未用待测液润洗
【答案】AC 加热、将固体混合物粉碎、搅拌(合理答案答一条均可) 3MnO2+KClO3+6KOH = 3K2MnO4+KCl+3H2O MnO2 H2O2![]() H++HO2- 、HO2-
H++HO2- 、HO2-![]() H++O22- 250mL容量瓶、玻璃棒 还原性 酸式 当滴入最后一滴酸性高锰酸钾溶液,锥形瓶内溶液颜色恰好由无色变为浅红色,且30秒内不褪色 0.1700mol/L A
H++O22- 250mL容量瓶、玻璃棒 还原性 酸式 当滴入最后一滴酸性高锰酸钾溶液,锥形瓶内溶液颜色恰好由无色变为浅红色,且30秒内不褪色 0.1700mol/L A
【解析】
黑色固体混合物水浸过滤得到滤渣和滤液,滤渣水洗灼烧后固体是一种黑色的化合物,操作a中加入氯酸钾和氢氧化钾反应得到熔块的主要成分是K2MnO4和KCl,溶解后通入二氧化碳气体反应后过滤得到化合物A为二氧化锰,滤液为高锰酸钾溶液,浓缩结晶得到高锰酸钾固体,
(1)高锰酸钾稀溶液是一种常用的消毒剂,是由于高锰酸钾具有强氧化性;
(2)①为提高浸出速率,可以升温、矿石粉碎、加速搅拌等措施;
②操作a中得到熔块的主要成分是K2MnO4和KCl,是固体二氧化锰和氯酸钾、氢氧化钾高温加热反应生成,结合氧化还原反应电子守恒和原子守恒配平书写化学方程式;
③分析可知图中产物A是一种难溶于水的黑色固体为二氧化锰;
(3)①H2O2为二元弱酸,水溶液中分步电离;
②配制250mL0.1000molL1标准Na2S2O3溶液需要计算、称量、溶解、冷却转移、洗涤转移、定容、摇匀等步骤,需要使用的玻璃仪器有烧杯、胶头滴管、量筒和玻璃棒、250ml容量瓶;
③据元素化合价判断;
④据KMnO4性质和颜色确定;
⑤根据反应2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2和c=n/v进行计算;
⑥据c(待测)=![]() 进行判断。
进行判断。
(1)高锰酸钾稀溶液是一种常用的消毒剂,是由于高锰酸钾具有强氧化性,其消毒机理与双氧水、84消毒液相同,
故选:AC;
(2)①黑色固体混合物水浸时为提高浸出速率,常采用的措施为加热、将固体混合物粉碎、搅拌等,
故答案为:加热、将固体混合物粉碎、搅拌;
②滤渣水洗灼烧后固体是一种黑色的化合物为二氧化锰,操作a中得到熔块的主要成分是K2MnO4和KCl,该过程中发生反应的化学方程式为3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O,
3K2MnO4+KCl+3H2O,
故答案为:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O;
3K2MnO4+KCl+3H2O;
③图中产物A是一种难溶于水的黑色固体,其化学式为MnO2,
故答案为:MnO2;
(3)①H2O2为二元弱酸,其酸性比碳酸弱,水溶液中分步电离,电离方程式为:H2O2![]() H++HO2-、HO2-
H++HO2-、HO2-![]() H++O22-
H++O22-
故答案为:H2O2![]() H++HO2-、HO2-
H++HO2-、HO2-![]() H++O22-;
H++O22-;
②配制250mL0.1000molL1标准Na2S2O3溶液需要计算、称量、溶解、冷却转移、洗涤转移、定容、摇匀等步骤,需要使用的玻璃仪器有烧杯、胶头滴管、量筒和玻璃棒、250mL容量瓶,
故答案为:玻璃棒、250mL容量瓶;
③2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑知H2O2中氧元素化合价升高,所以H2O2体现还原性,
故答案为:还原性;
④KMnO4强氧化性腐蚀橡胶,应装在酸式滴定管中,当滴加最后一滴KMnO4溶液时,锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内不褪色;
故答案为:酸式; 当滴入最后一滴酸性高锰酸钾溶液,锥形瓶内溶液颜色恰好由无色变为浅红色,且30秒内不褪色 ;
⑤由于第二次数据差过大,故舍去;其它三组的平均值=(17.10+17+16.90)![]() 3ml=17.00ml,根据反应2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2,
3ml=17.00ml,根据反应2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2,
n(H2O2)=2.5×n(MnO4)=2.5×0.1000molL1×0.017L,c(H2O2)=![]() =0.1700mol/L,
=0.1700mol/L,
故答案为:0.1700;
⑥A.滴定管在盛装高锰酸钾前未润洗导致溶液浓度减小,消耗标准溶液体积增大,测定结果偏高,故A正确;
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出,消耗标准溶液体积减少,测定结果偏低,故B错误;
C.滴定前读数正确,滴定终点时俯视读数,读取标准溶液体积减少,测定结果偏低,故C错误;
D.锥形瓶未用待测液润洗是正确操作,对测定结果无影响,故D错误;
故答案为:A。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】美托洛尔可用于治疗高血压及心绞痛,某合成路线如下:
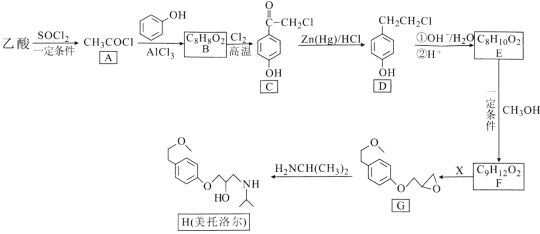
回答下列问题:
(1)美托洛尔分子中含氧官能团的名称是_____。
(2)A→B的反应类型是____,G的分子式为____。
(3)反应E→F的化学方程式为_______。
(4)试剂X的分子式为C3H5OCl,则X的结构简式为____。
(5)B的同分异构体中,含有苯环且能发生水解反应的共有____种,其中苯环上只有一个取代基且能发生银镜反应的结构简式为_____。
(6)4-苄基苯酚(![]() )是一种药物中间体,请设计以苯甲酸和苯酚为原料制备4-苄基苯酚的合成路线:__________(无机试剂任用)。
)是一种药物中间体,请设计以苯甲酸和苯酚为原料制备4-苄基苯酚的合成路线:__________(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、下图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前后盛放盐酸的滴定管中液面的位置。

实验编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的读数(mL) | 滴定后盐酸的读数(mL) |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 1.21 | 29.21 |
3 | 20.00 | 1.50 | 23.48 |
请回答下列问题:
(1)仪器A的名称是_________________。
(2)盐酸的体积读数:滴定前读数为___________,滴定后读数为_____________。
(3)某实验小组同学的三次实验的实验数据如上表所示。根据表中数据计算出待测NaOH溶液的平均溶度是____________mol/L(保留四位有效数字)。
(4)对下列几种假定情况进行讨论:
①取待测溶液的滴定管,放液前滴定管尖端有气泡,放液后气泡消失,对测定结果的影响是____________(填“无影响”“偏高”或“偏低”,下同)
②滴定前锥形瓶未用待测液润洗,对测定结果的影响是_______________;
Ⅱ、氧化还原滴定实验与酸碱中和滴定类似,原理是用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。现用0.001mol/L酸性KMnO4溶液滴定位置浓度的Na2SO3溶液,反应的离子方程式是2MnO4- + 5SO32- + 6H+=2Mn2+ + 5SO42- + 3H2O。请回答下列问题:
(1)该滴定实验所需仪器有________________。
A、酸式滴定管(50mL) B、碱式滴定管(50mL) C、量筒(10mL) D、锥形瓶 E、铁架台F、滴定管夹 G、烧杯 H、胶头滴管 I、漏斗
(2)实验时,应用_____________(填“酸式”或“碱式”,下同)滴定管盛放高锰酸钾溶液,应用__________滴定管盛放亚硫酸钠溶液。
(3)该实验_____________(填“需要”或“不需要”)加入指示剂,原因是_____________。滴定达到终点的标志是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的Ka1=1.1×103 ,Ka2=3.9×106)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是

A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2的导电能力之和大于HA的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是


A.图甲中纯水仅升高温度,就可以从a点变到c点
B.图甲中在b点对应温度下,将pH=2的H2SO4溶液与pH=10的NaOH溶液等体积混合后,溶液显中性
C.图乙表相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
D.图丙表示20oC时用0.100mol/L氢氧化钠溶液分别滴定20.00mL0.100mol/L的盐酸和醋酸,V(NaOH)=20.00mL时,两份溶液中c(Cl-)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发酵法制酒精的过程可粗略表示如下:
①(C6H10O5)n+nH2O![]() nC6H12O6 ②C6H12O6
nC6H12O6 ②C6H12O6![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
(1)上述化学方程式中(C6H10O5)n可能表示_____ ____(填物质名称);
(2)C6H12O6名称是_________,常用_____ ____试剂来检验其存在;
(3)为检验苹果成熟过程中发生了反应①,可在青苹果汁中滴加碘酒,溶液呈_________色,向熟苹果汁中加入Cu(OH)2悬浊液,加热,反应生成____ ____(填实验现象);
(4)下列作用不属于水解反应的是_________
A.吃馒头时多咀嚼后有甜味
B.淀粉溶液和稀硫酸共热一段时间后,滴加碘水不显蓝色
C.不慎将浓硝酸沾到皮肤上会出现黄色斑痕
D.油脂与氢氧化钠溶液共煮后可以制得肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.按系统命名法,有机物![]() 可命名为3,7-二甲基-4-乙基辛烷
可命名为3,7-二甲基-4-乙基辛烷
B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C.苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段为![]() 的高聚物,其单体是甲醛和苯酚
的高聚物,其单体是甲醛和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mgL-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示):____________,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。

① 开始时阳极的电极反应式为________________。
② 电解一段时间,____极(填“阴”或“阳”)会产生水垢,其成份为_____(填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:

该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示_____(填粒子符号),充电时该电极反应式为_______。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为_________(空气中氧气的体积分数按20%计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com