
【题目】硫、氮的氧化物是形成酸雨的主要原因,一种比较常用的方法是用NH3处理氮的氧化物(NxOy)。完成下列问题。
(1)已知:①2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1253.4kJ/mol
则用NH3处理NO生成氮气和气态水的热化学方程式为__。
(2)已知:N2(g)+3H2(g)![]() 2NH3(g) △H<0。不同温度下,向三个一样的容器中投入相同的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
2NH3(g) △H<0。不同温度下,向三个一样的容器中投入相同的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。

①M点的v正__Q点的v正(填“>”“<”或“=”),原因是__。
②维持10MPa、T3℃的条件不变,要提高H2的转化率,可以采取的措施是__(任写一条)。
③图中三条曲线对应的温度T1、T2、T3由高到低的顺序为___。
④恒温恒容条件下,能说明反应N2(g)+3H2(g)![]() 2NH3(g)达到平衡状态的是__(填选项字母)
2NH3(g)达到平衡状态的是__(填选项字母)
A.![]() 保持不变
保持不变
B.3molH-H键断裂的同时,有2molN-H键断裂
C.2v(N2)=v(NH3)
D.反应器中的压强不再发生变化
⑤T3温度下,将1molN2和3molH2充入2L的恒容密闭容器中反应,一段时间后达到N点的平衡状态,则反应的平衡常数为K=__(结果保留2位小数),M点与Q点对应的平衡常数大小关系为M__Q(填“>”“<”或“=”)。
【答案】4NH3(g) + 6NO(g)=5N2(g) +6H2O(g) △H=-1784.4kJ/mol > 其他条件相同,M点压强大,反应速率快 增大氮气的浓度(或及时分离出氨气) T3>T2>T1 AD 0.33 =
【解析】
(1)NH3和NO生成氮气和气态水的化学方程式为4NH3(g)+6NO(g)═5N2(g)+6H2O(g),据此根据盖斯定律得到热化学方程式;
(2)①Q、M两点在同一等温曲线上,但M点压强高,根据压强对化学反应速率影响解答;
②根据影响化学平衡移动的因素知识来回答判断;
③N2(g)+3H2(g)2NH3(g)是正向体积减小的放热反应,压强相同时,升高温度,平衡逆向进行,氨气的含量降低,即温度越高,氨气的含量越小,据此解答;
④反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,可以及由此衍生的一些量也不发生变化,据此判断;
⑤利用三段式计算N点各物的物质的量,再根据物质的量之比等于体积之比计算平衡时容器体积,转化为各物质的浓度代入平衡常数表达式计算k,平衡常数只与温度有关,据此解答。
(1)NH3和NO生成氮气和气态水的化学方程式为4NH3(g)+6NO(g)═5N2(g)+6H2O(g),有盖斯定律①×3+②得到4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H=(-177kJ/mol)×3+(-1253.4kJ/mol)-1784.4kJ/mol,故答案为:4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H=-1784.4kJ/mol;
(2)①Q、M两点在同一等温曲线上,但M点压强高,所以M点反应速率大,故答案为:>,其他条件相同,M点压强大,反应速率快;
②一定条件下的密闭容器中,反应达到平衡后,要提高H2的转化率,即使化学平衡正向进行即可:可以增加反应物N2的浓度、分离出NH3(减小生成物的浓度),加入催化剂不会改变反应物的转化率,但增加H2的浓度会使得氢气的转化率减小,故答案为:增大氮气的浓度,或及时分离出氨气;
③N2(g)+3H2(g)2NH3(g)是正向体积减小的放热反应,温度越高,氨气的含量越小,观察图象可知:T1时氨气含量最高,T3时氨气含量最低,所以温度过低顺序为:T3>T2>T1,故答案为:T3>T2>T1;
④A、比例式的比值不变,说明氢气、氮气、氨气的浓度不变,符合平衡状态的本质特征,即反应达到平衡状态,故A正确;
B、3molH-H键断裂的同时,有6molN-H键断裂时,反应达到平衡状态,但3molH-H键断裂的同时,有2molN-H键断裂时,反应正向进行,故B错误;
C、2v正(N2)=v逆(NH3)时,反应达到平衡,但2v(N2)=v(NH3)时不能确定反应是否平衡:可能是正向进行,也可能达到平衡,还可能是逆向进行,故C错误;
D、反应正向进行,气体体积减小,压强随之减小,反应逆向进行,气体体积增大,压强随之增大,所以压强不变,反应达到平衡,故D正确;故答案为:AD;
⑤反应的三段式:N2(g)+3H2(g)2NH3(g)
起始量(mol) 1 3 0
变化量(mol)x 3x 2x
平衡量(mol) 1-x3-3x2x
平衡时氨气的含量为20%,即![]() ×100%=20%,x=
×100%=20%,x=![]() mol,N2、H2、NH3的物质的量分别为
mol,N2、H2、NH3的物质的量分别为![]() mol、2mol、
mol、2mol、![]() mol,容器的体积为2L,即c(N2)=c(NH3)=
mol,容器的体积为2L,即c(N2)=c(NH3)=![]() mol/L,c(H2)=1mol/L,平衡常数k=
mol/L,c(H2)=1mol/L,平衡常数k=![]() =
=![]() =0.33;平衡常数只与温度有关,M点与Q点温度相同,故平衡常数相等,故答案为:0.33; =。
=0.33;平衡常数只与温度有关,M点与Q点温度相同,故平衡常数相等,故答案为:0.33; =。


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )
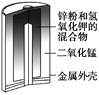
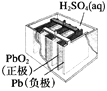
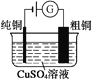
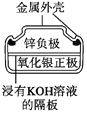
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A. 图1所示电池中,MnO2的作用是催化剂
B. 图2所示电池放电过程中,硫酸浓度不断增大
C. 图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如图所示:
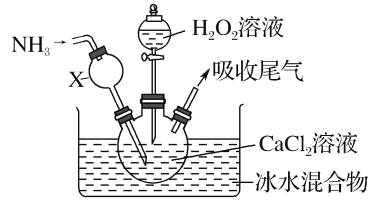
回答下列问题:
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有___。
(2)仪器X的主要作用除导气外,还具有的作用是___。
(3)在冰水浴中进行的原因是___。
(4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为___。
(5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是____。
A.无水乙醇 B.浓盐酸 C.Na2SO3溶液 D.CaCl2溶液
(6)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为:
①Fe3+ +H2O2=Fe2++H++HOO·
②H2O2+X=Y +Z+W(已配平)
③Fe2++·OH=Fe3++OH-
④H+ +OH-=H2O
根据上述机理推导步骤②中的化学方程式为___。
(7)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙具有____的性质。
A.与水缓慢反应供氧 B.能吸收鱼苗呼出的CO2气体
C.能是水体酸性增强 D.具有强氧化性,可杀菌灭藻
(8)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。
该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。
则:所得过氧化钙样品中CaO2的纯度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>CB. 原子序数:d>c>b>a
C. 离子半径:C>D>B>AD. 单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为科学家正在研发的新型电池,该电池容量大,电流稳定等多方面优点。该电池的电池总反应式为:Na(1-x)MO2+NaxCn![]() NaMO2+nC,下列说法正确的是( )
NaMO2+nC,下列说法正确的是( )
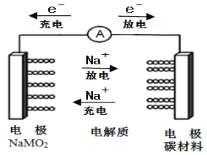
A.电池充电时,NaMO2电极为阳极
B.放电时,负极反应式:NaMO2-xe-=Na(1-x)MO2+xNa+
C.电解质可以选用无水乙醇
D.充电时,阳极反应式为:nC+xNa++xe-=NaxCn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作为电解质,向负极充入燃料气CH4,用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中,CO32-移向__极(填“正”或“负”),负极的电极反应式为__,正极的电极反应式为___。
(2)某实验小组同学对电化学原理进行了一系列探究活动。
①如图为某实验小组依据的氧化还原反应:__(用离子方程式表示)设计的原电池装置。
②其他条件不变,若将CuCl2溶液换为HCl溶液,石墨的电极反应式为___。

(3)如图为相互串联的甲、乙两电解池,其中甲池为电解精炼铜的装置。试回答下列问题:

①A极材料是___,电极反应为___,B极材料是__,主要电极反应为__,电解质溶液为___。
②乙池中若滴入少量酚酞溶液,电解一段时间后Fe极附近溶液呈___色。
③常温下,若甲池中阴极增重12.8g,则乙池中阳极放出的气体在标准状况下的体积为___,若此时乙池剩余液体为400mL,则电解后溶液pH为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过程实践的检验才能确定其正确与否。下列几种类推结论中,正确的是
A.由2Cu+O2![]() 2CuO可推出同族的硫也有Cu+S
2CuO可推出同族的硫也有Cu+S![]() CuS
CuS
B.![]() 可表示为
可表示为![]() ,则
,则![]() 可表示为
可表示为![]()
C.过量的![]() 与石灰水反应生成
与石灰水反应生成![]() ,过量
,过量![]() 通入漂白粉溶液中,产物是
通入漂白粉溶液中,产物是![]() 和HClO
和HClO
D.![]() 与过氧化钠反应只生成
与过氧化钠反应只生成![]() 和
和![]() 故
故![]() 与过氧化钠一定生成
与过氧化钠一定生成![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含![]() 明矾的溶液中加入含
明矾的溶液中加入含![]() 的溶液,下列说法正确的是
的溶液,下列说法正确的是![]()
![]()
A.该过程中先产生白色沉淀,后沉淀部分溶解,质量减少
B.当![]() 时,发生
时,发生![]()
C.当![]() 时,溶液中
时,溶液中![]() :
:![]() :
:![]()
D.当![]() 时,所得沉淀的物质的量达最大值
时,所得沉淀的物质的量达最大值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属混合物粉末15 g与足量的盐酸反应时生成标准状况下11.2 L氢气,符合上述情况的金属混合物
A.Mg、FeB.Zn、AgC.Zn、FeD.Mg、Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com