
����Ŀ����������ͼ(������Ϊ����������������Ϊ���������)���Ӧѡ���ȷ����( )

A.��1LŨ�Ⱦ�Ϊ0.1mol/L��Ba(OH)2��NaAlO2���Һ�м���0.1 mol/LϡH2SO4��Һ
B.����0.1 mol/L AlCl3��0.3mol/L NH4Cl��1L���Һ�м���0.1mol/L NaOH��Һ
C.���ռ���Һ�еμ�������Һ
D.��Ca(OH)2��Һ����ͨ�������̼
���𰸡�A
��������
A��Ba(OH)2��NaAlO2���Һ�м���ϡH2SO4��Һ������кͷ�Ӧ�ȷ��������������ᱵ���������Է�Ӧ��ʼ���г������ɣ�Ȼ���������NaAlO2������Ӧ�Ĺ��̣�������2.5L���ᣬ������������ȫ���ܽ⣬��A����
B��AlCl3��NH4Cl��1L���Һ�м���NaOH��Һ���ȳ��ְ�ɫ��������������Ȼ����笠����Ӻ�����������֮�䷴Ӧ����һˮ�ϰ�����������������ܽ�Ĺ��̣�����NaOH����֮����3��3��1����B��ȷ��
C�������������м���������ʼ�μ������������ֳ�����Ȼ���������Ӻ�ƫ�����������������������Ĺ��̣���C��ȷ��
D��Ca(OH)2��Һ����ͨ�������̼����ʼ����ְ�ɫ������Ȼ���������ʧ�������������ĵĶ�����̼������ȣ���D��ȷ��
��ѡA��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�ְ�ɫ���壬������ˮ���������Ҵ�����ѧ����������������ơ�ijѧϰС������ڼ��Ի���������CaCl2��H2O2��Ӧ��ȡCaO2��8H2O��װ����ͼ��ʾ��
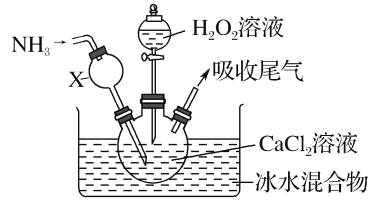
�ش��������⣺
��1��С��ͬѧ��������֪����ʵ������������Ϊ20%��H2O2��Һ��Ϊ���ˡ�����H2O2��Һ����������Ϊ30%����С��ͬѧ������H2O2��Һ����Լ20%��H2O2��Һ�Ĺ����У�ʹ�õIJ�������������������ͷ�ι��⣬����___��
��2������X����Ҫ���ó������⣬�����е�������___��
��3���ڱ�ˮԡ�н��е�ԭ����___��
��4��ʵ��ʱ����������ƿ������CaO2��8H2O���壬�ܷ�Ӧ�����ӷ���ʽΪ___��
��5����Ӧ���������ˡ�ϴ�ӡ����º�ɻ��CaO2��8H2O�������Լ��У�ϴ��CaO2��8H2O�����ѡ����____��
A����ˮ�Ҵ� B��Ũ���� C��Na2SO3��Һ D��CaCl2��Һ
��6����CaCl2ԭ���к���Fe3+���ʣ�Fe3+���ֽ�H2O2����ʹH2O2�����������Խ��͡���Ӧ�Ļ���Ϊ��
��Fe3+ +H2O2=Fe2++H++HOO��
��H2O2+X=Y +Z+W������ƽ��
��Fe2++��OH=Fe3++OH-
��H+ +OH-=H2O
�������������Ƶ�������еĻ�ѧ����ʽΪ___��
��7���������ƿ����ڳ�;�������磬�������˹������ƾ���____�����ʡ�
A.��ˮ������Ӧ���� B.���������������CO2����
C.����ˮ��������ǿ D.����ǿ�����ԣ���ɱ������
��8��������CaO2��8H2O������ȵ�150~160�棬��ȫ��ˮ��õ�����������Ʒ��
��С��ⶨ����������Ʒ��CaO2�Ĵ��ȵķ����ǣ�ȷ��ȡ0.4000g����������Ʒ��400�����ϼ�������ȫ�ֽ��CaO��O2(�����ʲ���������)���õ�33.60mL(�ѻ���Ϊ��״��)���塣
�����ù���������Ʒ��CaO2�Ĵ���Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ƶ�˼ά�����ڻ�ѧѧϰ���о��г����������Ľ��ۣ�������ƵĽ�������Ҫ������ʵ���ļ������ȷ������ȷ������м������ƽ����У���ȷ����
A.��2Cu+O2![]() 2CuO���Ƴ�ͬ�����Ҳ��Cu+S
2CuO���Ƴ�ͬ�����Ҳ��Cu+S![]() CuS
CuS
B.![]() �ɱ�ʾΪ
�ɱ�ʾΪ![]() ����
����![]() �ɱ�ʾΪ
�ɱ�ʾΪ![]()
C.������![]() ��ʯ��ˮ��Ӧ����
��ʯ��ˮ��Ӧ����![]() ������
������![]() ͨ��Ư����Һ�У�������
ͨ��Ư����Һ�У�������![]() ��HClO
��HClO
D.![]() ��������Ʒ�Ӧֻ����
��������Ʒ�Ӧֻ����![]() ��
��![]() ��
��![]() ���������һ������
���������һ������![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() ��������Һ�м��뺬
��������Һ�м��뺬![]() ����Һ������˵����ȷ����
����Һ������˵����ȷ����![]()
![]()
A.�ù������Ȳ�����ɫ����������������ܽ⣬��������
B.��![]() ʱ������
ʱ������![]()
C.��![]() ʱ����Һ��
ʱ����Һ��![]() ��
��![]() ��
��![]()
D.��![]() ʱ�����ó��������ʵ��������ֵ
ʱ�����ó��������ʵ��������ֵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��10 ��ʱ����NaHCO3������Һ����ø���Һ��pH�������±仯��
�¶�(��) | 10 | 20 | 30 | 50 | 70 |
pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
(1)��ͬѧ��Ϊ������ҺpH���ߵ�ԭ����HCO3-��ˮ��̶���������ǿ���÷�Ӧ�����ӷ���ʽΪ____________________��
(2)��ͬѧ��Ϊ������ҺpH���ߵ�ԭ����NaHCO3���ȷֽ⣬������Na2CO3�����ƶ�Na2CO3��ˮ��̶�________ (����ڡ���С�ڡ�)NaHCO3��ˮ��̶ȡ�
(3)��ͬѧ��Ϊ��Ҫȷ����������˵��������ֻҪ�Ѽ��Ⱥ����Һ��ȴ��10����ٲⶨ��Һ��pH����pH______8.3���������������=������ͬ����˵����ͬѧ��ȷ����_______8.3��˵����ͬѧ��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ����2.0molA(g)��2.0molB(g)�������Ϊ1L���ܱ������У���һ����������������Ӧ:A(g)+B(g)![]() 2C(g)+D(s)��H<0��tʱ�̷�Ӧ�ﵽƽ��ʱ��C(g)Ϊ2.0mol������˵����ȷ����
2C(g)+D(s)��H<0��tʱ�̷�Ӧ�ﵽƽ��ʱ��C(g)Ϊ2.0mol������˵����ȷ����
A. tʱ�̷�Ӧ�ﵽƽ��ʱ��A(g)���������Ϊ20%
B. T��ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��Kc=2
C. tʱ�̷�Ӧ�ﵽƽ�����С���������ƽ�������ƶ�
D. ��ͬ�����£�����1.0molA(g)��1.0molB(g)����ͬ���������ﵽƽ���A(g)��ת����Ϊ50%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�з���ͼ�����

A.2SO3(g) ![]() 2SO2(g)��O2(g) ��H=��Q2kJ��mol��1(Q2>0)
2SO2(g)��O2(g) ��H=��Q2kJ��mol��1(Q2>0)
B.H2(g)��CO(g) ![]() C(s)��H2O(g) ��H=��Q4kJ��mol��1(Q4>0)
C(s)��H2O(g) ��H=��Q4kJ��mol��1(Q4>0)
C.N2(g)��3H2(g) ![]() 2NH3(g) ��H =-Q1kJ��mol-1 ��Q1>0��
2NH3(g) ��H =-Q1kJ��mol-1 ��Q1>0��
D.4NH3(g)��5O2(g) ![]() 4NO(g)��6H2O(g) ��H =-Q3kJ��mol-1 ��Q3>0��
4NO(g)��6H2O(g) ��H =-Q3kJ��mol-1 ��Q3>0��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֽ���������ĩ15 g�����������ᷴӦʱ���ɱ�״����11.2 L������������������Ľ��������
A.Mg��FeB.Zn��AgC.Zn��FeD.Mg��Al
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����84������Һ(��ҵ����Cl2��NaOH��Ӧ�Ƶã�������������Ư�ף�����ʵ������ķ�������ȷ����
ʵ����� |
|
|
|
ʵ������ | ��Ϻ���Һ��pH=9.9,��ʱ����δ��ɫ��һ��ʱ�����ɫ��ȥ�� | ��Ϻ���ҺpH=5.0����ɫѸ����ȥ������������� | ��Ϻ���ҺpH=3.2����ɫѸ����ȥ���������������壬ʹʪ��ĵ��۵⻯����ֽ������ |
A.�Ա�ʵ����������������ɫѸ����ȥ��ԭ���Ƿ����˷�ӦClO+H+�THClO
B.ʵ�����в�����������Cl2����HClO�ֽ�õ���2HClO�TCl2��+H2O
C.�Ա�ʵ������������Һ��pH���ܻ�Ӱ��ClO�������Ի�Cl�Ļ�ԭ��
D.������������84������Һ��Ư��Ч��������Ҫ���غ��ʵ�pH���ܰ�ȫʹ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com