
【题目】工业上常以铜铁矿(主要成分为CuO和Fe3O4,还含少量SiO2等杂质)为原料,冶炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下
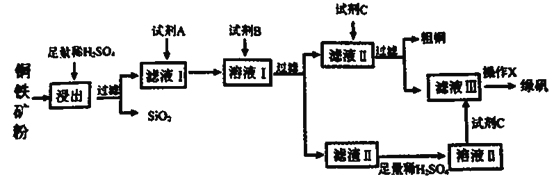
已知:滤渣II的主要成分为Fe(OH)3。请回答下列问题:
(1)如何提高黄铜矿的浸出率___________、___________?(至少答两种方法)
(2)试剂A为___________,其反应的离子方程式为_____________。
(3)试剂B不可能是
A.NH3·H2O B.CuO C.NaOH D.Cu2(OH)2CO3
(4)溶液II中溶质的成分为_______________。
(5)操作X的步骤是________________________。
【答案】加热、搅拌 H2O2 2Fe2++2H++H2O2=2Fe3++2H2O AC CuSO4、Fe2(SO4)3、H2SO4 蒸发浓缩、冷却结晶、过滤
【解析】
以铜铁矿(主要成分为CuO和Fe3O4,还含少量SiO2等杂质)为原料,冶炼铜,同时得到副产品绿矾(FeSO47H2O),由流程可知铜铁矿加入稀硫酸,过滤可除去SiO2,滤液中含有硫酸铜、硫酸铁以及硫酸亚铁等,加入试剂A为过氧化氢,可用于氧化亚铁离子生成铁离子,试剂B为CuO等,用于调节溶液pH,目的是生成氢氧化铁,过滤,滤渣Ⅱ为Fe(OH)3,加入稀硫酸,得到溶液Ⅱ为硫酸铁,加入铁粉,可生成硫酸亚铁,滤液Ⅱ加入铁可置换出铜,滤液Ⅲ为硫酸亚铁溶液,经蒸发浓缩、冷却结晶可得到绿矾,以此解答该题。
(1)提高黄铜矿的浸出率,可进行加热、搅拌等操作;
(2)试剂A为H2O2,目的是将Fe2+氧化为Fe3+,有利于分离,反应离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O
(3)试剂B为CuO等,用于调节溶液pH,避免引入新杂质,不能用NH3H2O、NaOH等,故答案为:AC;
(4)滤渣Ⅱ主要成分为Fe(OH)3,可能含有CuO等,则溶液Ⅱ中溶质的成分为CuSO4、Fe2(SO4)3、H2SO4;
(5)操作X由溶液可得晶体,可进行蒸发浓缩、冷却结晶、过滤等操作。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】将![]() 转变为
转变为![]() 的方法为( )
的方法为( )
A.与足量的NaOH溶液共热后,再通入CO2
B.溶液加热,通入足量的HCl
C.与稀H2SO4共热后,加入足量的Na2CO3
D.与稀H2SO4共热后,加入足量的NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是( )
A.步骤(1)产物中残留的苯酚可用![]() 溶液检验
溶液检验
B.苯酚和菠萝酯均可与酸性![]() 溶液发生反应
溶液发生反应
C.苯氧乙酸和菠萝酯均可与![]() 溶液发生反应
溶液发生反应
D.步骤(2)产物中残留的烯丙醇可用溴水检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1) 图1是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH________0(填“>”“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图2所示。则该反应的平衡常数为______________。

③若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2) 在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________℃;该温度下上述反应的化学平衡常数为________。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性条件下,黄铁矿(FeS2)催化氧化的反应方程式为2FeS2 + 7O2+ 2H2O ═ 2Fe2+ + 4SO42 + 4H+实现该反应的物质间转化如图所示。下列分析正确的是

A.反应Ⅰ的离子方程式为4Fe(NO)2+ + O2+ 4H+ ═ 4Fe3+ +4NO + 2H2O,Fe(NO)2+作氧化剂
B.反应Ⅱ中Fe3+作氧化剂,FeS2被还原
C.在酸性条件下,黄铁矿催化氧化中NO作催化剂
D.反应Ⅲ的离子方程式为Fe2+ + NO ═Fe(NO)2+,该反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的是( )
A.  制取乙酸乙酯
制取乙酸乙酯
B.  吸收NH3
吸收NH3
C.  石油的分馏
石油的分馏
D.  比较盐酸、碳酸、苯酚的酸性强弱
比较盐酸、碳酸、苯酚的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验与图象不对应的是
选项 | A | B | C | D |
实验 | 向NH4C1溶液中加入过量Na2O2固体 | 向稀硝酸溶液中加入过量的铁粉 | 明矾溶液中逐滴加Ba(OH)2溶液至过量 | 向含等物质的量的NaOH和Na2CO3的混合溶液中滴加过量的稀盐酸 |
图象 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图某有机物的结构简式为:
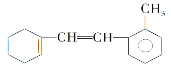
①1mol该物质和溴水反应,消耗Br2的物质的量为__mol;
②该物质与足量氢气完全加成后环上的一氯代物有__种;
(2)现有六种有机物,请回答下列问题:
A.![]() B.
B.![]() C.
C.![]() D.
D.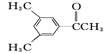 E.
E.![]() F.
F.![]()
①上述化合物中互为同分异构体的是__;互为同系物的是__。
②A物质中含有的官能团名称为__。
③D的一氯代物最多有__种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定烟雾中的SO2含量,可做下列实验:取100 L该烟雾(标准状况),通过盛放100 mL过氧化氢(H2O2)水溶液的吸收瓶,使它们充分反应,生成硫酸。在吸收后的水溶液中加入BaCl2溶液,生成白色沉淀,经测定其质量为11.65 g,则该烟雾中SO2的体积分数是( )
A. 1.12% B. 2.24%
C. 3.36% D. 无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com