
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的ΔH______0(填“<”“>”或“=”)。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时c(A)=________mol·L-1,C的物质的量为________mol;若反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为________。
(3)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
【答案】< 0.022 0.09 80% 80% 2.5
【解析】
(1)由表中数据可知,温度升高平衡常数降低,平衡向逆反应移动,故正反应为放热反应;
(2)根据![]() 计算
计算![]() ,A的起始浓度-
,A的起始浓度-![]() =6s时
=6s时![]() ;根据
;根据![]() 计算
计算![]() ,再根据方程式计算C的物质的量;设平衡时A的浓度变化量为x,利用三段式表示平衡时各组分的平衡浓度,代入平衡常数列方程计算x的值,再根据转化率定义计算;恒容容器充入稀有气体,平衡不移动,转化率不变;
,再根据方程式计算C的物质的量;设平衡时A的浓度变化量为x,利用三段式表示平衡时各组分的平衡浓度,代入平衡常数列方程计算x的值,再根据转化率定义计算;恒容容器充入稀有气体,平衡不移动,转化率不变;
(3)同一温度下,同一反应的正、逆反应的平衡常数互为倒数。
(1)由表中数据可知,温度升高平衡常数降低,平衡向逆反应移动,故正反应为放热反应,即△H<0;
(2)反应初始6s内A的平均反应速率![]() ,则6s内
,则6s内![]() ,A的起始浓度为
,A的起始浓度为![]() ,故6s时时
,故6s时时![]() ,故6s内
,故6s内![]() ,由方程式可知
,由方程式可知![]() ,设平衡时A的浓度变化量为x,则:
,设平衡时A的浓度变化量为x,则:
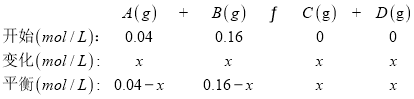
故![]() ,解得x=0.032,所以平衡时A的转化率为
,解得x=0.032,所以平衡时A的转化率为![]() ;向该密闭容器中再充入1 mol氩气,因该容器为恒容容器,加入不参与反应的气体,平衡不移动,故A转化率还是80%;
;向该密闭容器中再充入1 mol氩气,因该容器为恒容容器,加入不参与反应的气体,平衡不移动,故A转化率还是80%;
(3)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数,故1200℃时反应![]() 的平衡常数的值为
的平衡常数的值为![]() 。
。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】图所示与对应叙述相符的是
A. 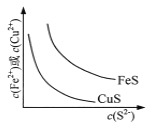 表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) <Ksp(CuS)
表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) <Ksp(CuS)
B. 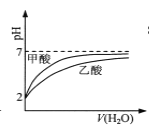 pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 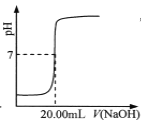 表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 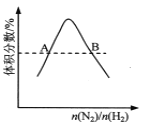 反应N2(g)+3H2(g)
反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300℃时,将2molA和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8molD。
2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8molD。
(1)300℃时,该反应的平衡常数表达式为:K=___。已知K300℃<K350℃,则ΔH__0(填“>”或“<”)。
(2)在2min末时,B的平衡浓度为___,D的平均反应速率为___。
(3)若温度不变,缩小容器容积,则A的转化率___(填“增大”“减小”或“不变”),原因是___。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一反应:2A(g)+B(g)![]() 2C(g),图中的曲线是该反应在不同温度下的平衡曲线,则下列描述不正确的是( )
2C(g),图中的曲线是该反应在不同温度下的平衡曲线,则下列描述不正确的是( )

A.该反应是吸热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1时若由a点达到平衡,可以采取增大压强的方法
D.c点v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是可逆反应 A + 2B![]() 2C + 3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C + 3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
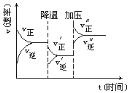
A.若 A、B 是气体,则 D 是液体或固体
B.A、B、C、D均为气体
C.逆反应是放热反应
D.达平衡后,v(A)正 = 2v(C)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,各物质浓度随时间变化的关系如图所示:

计算该反应的平衡常数K=________。反应进行到20 min时,再向容器内充入一定量NO2,10 min后达到新的平衡,此时测得c(NO2)=0.9 mol·L-1。第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1________w2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气充电电池有望成为电动汽车的实用储能设备。工作原理示意图如下,下列叙述正确的是
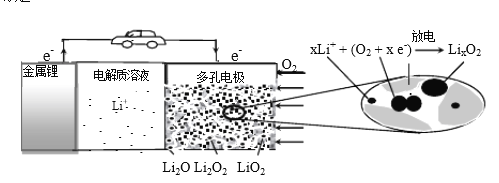
A. 该电池工作时Li+向负极移动
B. Li2SO4溶液可作该电池电解质溶液
C. 电池充电时间越长,电池中Li2O 含量越多
D. 电池工作时,正极可发生: 2Li+ +O2+ 2e-=Li2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某个容积为2 L的密闭容器内,在T℃时按下图1所示发生反应:

mA(g)+nB(g)![]() pD(g)+qE(s) H<0(m、n、p、q为最简比例的整数)。
pD(g)+qE(s) H<0(m、n、p、q为最简比例的整数)。
(1)根据图1所示,反应开始至达到平衡时,用D表示该反应速率为____________ mol/(L·min);方程式中m:n:p:q =________________
(2)该反应的化学平衡常数K为_________________(保留至一位小数);
(3)下列措施能增大B的转化率的是 ( )
A.升高温度 B.保持体积不变通入1molB
C.保持体积不变移出部分物质D(g) D.将容器的容积增大为原来的2倍
E. 保持体积不变通入1mol A
(4)能判断该反应已经达到化学平衡状态的是( )
A.恒容恒温时容器中气体压强保持不变
B.混合气体中D浓度不变
C.v(A)正 = v(A)逆
D.恒容时容器中气体密度不变
(5)反应达到平衡后,第7 min时,改变条件,在第9min达到新的平衡,在图2上作出第7 min至第15 min(作在答题纸上):下列情况下,D浓度变化图像
①若降低温度且平衡时D物质的量变化了0.4 mol (用虚线)
②若将容器的容积压缩为原来一半(用实线)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ/mol
1molCO和3molCH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
A.2912kJB.2953kJC.3236kJD.3867kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com