
【题目】下列物质既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是
①KHCO3 ②(NH4)2CO3③Al2O3④Al(OH)3
A.全部B.只有①③④C.只有③④D.只有②③④
科目:高中化学 来源: 题型:
【题目】(14分)已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) 。
(2)Z在元素周期表中的位置为 。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) 。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,在实验室中,制取该物质的反应原理是(写化学方程式) 。
(5)M2Z的电子式为 。MX与水反应可放出气体,该反应的化学方程式为 。
(6)常温下,不能与G的单质发生反应的是(填序号) 。
a.CuSO4溶液 b.Fe2O3c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
工业上用电解法制G的单质的化学方程式是 ,若以石墨为电极,阳极产生的混合气体的成分是(写化学式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝:
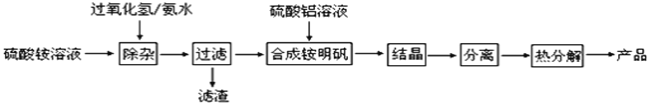
(1)“除杂”操作是加入H2O2后,然后用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中少量的Fe2+。
①酸性溶液中Fe2+与H2O2反应的离子方程式为___。
②过滤操作中所得到滤渣主要成分的化学式为___。
(2)检验上述流程中“过滤”后杂质是否除尽的实验方法___。
(3)配制硫酸铝溶液时,需用硫酸酸化的目的是___。
(4)“结晶”操作中,得到铵明矾晶体(NH4Al(SO4)212H2O),采用的操作是___。
(5)铵明矾晶体的化学式为NH4Al(SO4)212H2O,在0.1mol/L铵明矾的水溶液中,c(NH4+)、c(Al3+)、c(SO42﹣)三种离子浓度由大到小的顺序为___。
Kb(NH3·H2O)=1.8×10-5KbAl(OH)3=1.38×10-9
(6)向铵明矾溶液中加入过量NaOH溶液,反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.FeCl3溶液与Cu的反应:Fe3++Cu=Fe2++Cu2+
B.AgNO3溶液与NaCl溶液的反应:Ag++Cl-=AgCl↓
C.Cu(OH)2与CH3COOH溶液的反应:OH-+H+=H2O
D.CaCO3与HNO3溶液的反应:![]() +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)滤渣a中除含泥沙外,一定含有____,分离溶液a和滤渣a的操作需要的玻璃仪器为__________________。
(2)溶液a中含铝元素的溶质与过量试剂A反应的离子方程式为_______________,溶液a与过量试剂A反应生成滤渣b的离子方程式为__________________。
(3)溶液b与过量试剂B反应生成滤渣c的离子方程式为_______________________。
(4)加热滤渣c得到氧化铝的操作需要使用的仪器除了酒精灯、三角架、泥三角,还有________(填主要仪器名称),实验室里还常往NaAlO2溶液中通入过量的_______来制取A1(OH)3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒被称为“工业味精”“工业维生素”,在发展现代工业、国防等方面发挥着至关重要的作用。某高铬型钒渣含Fe2O3、Fe3O4、SiO2、Al2O3、V2O5、Cr2O3等物质,从中分离提取钒铬的工艺流程如下:

回答下列问题:
(1)“焙烧”时会生成NaVO3和Na2CrO4,生成Na2CrO4的化学方程式是_________。
(2)滤渣1中主要含_______。滤渣2的主要成分是Fe(OH)3和Al(OH)3,对应调pH应不低于_____。(常温下,当溶液中离子浓度小于1×10-6mol/L时认为沉淀完全, Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-33)
(3)“沉钒”所用0.1mol/L (NH4)2SO4溶液中,离子浓度由大到小的顺序是_______。
(4)“还原”时溶液的pH在2.5左右,此时控制酸度应选用_______(填标号)。
A.稀盐酸 B.稀硫酸 C.稀硝酸 D.硫酸铵
(5)NH4VO3、Cr(OH)3煅烧时发生反应的类型是否相同?___________。
(6)工业上可用电解还原法处理含Cr2O72- 的酸性废水。用铁板作阳极,电解过程中,废水pH逐渐上升,Cr3+、Fe3+都以氢氧化物沉淀析出,达到废水净化的目的。
①其中阳极的电极反应式是___________。
②电解过程中,废水pH上升的原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列说法正确的是
A.12g![]() 的原子核内中子数为6NA
的原子核内中子数为6NA
B.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA
C.25℃时,1LpH=2的H2C2O4溶液中含H+的数目为0.02NA
D.标准状况下,2.24LCO2与足量Na2O2反应转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用pH传感器进行数字化实验,分别向两个盛50mL 0.100mol/L 盐酸的烧杯中匀速滴加50mL 去离子水、50mL 0.100mol/L 醋酸铵溶液,滴加过程进行磁力搅拌,测得溶液pH随时间变化如下图所示。已知常温下醋酸铵溶液pH=7,下列说法错误的是

A.曲线X表示盐酸中加水稀释的pH变化
B.曲线Y的pH变化主要是因为CH3COO-与H+结合成了弱电解质
C.a点对应的溶液中c(Cl-)+c(CH3COO-)+c(CH3COOH)-c(NH4+)=0.01mol/L
D.b点对应的溶液中水电离的c(H+)=10-12.86mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I具有贝类足丝蛋白的功能,可广泛用于表面化学、生物医学、海洋工程、日化用品等领域。其合成路线如图:
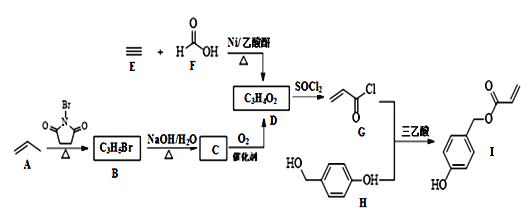
回答下列问题:
(1)I中含氧官能团的名称为____。
(2)由B生成C的化学方程式为__。
(3)由E和F反应生成D的反应类型为____,由G和H反应生成I的反应类型为____。
(4)仅以D为单体合成高分子化合物的化学方程式为___。
(5)X是I的芳香同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1。写出两种符合要求的X的结构简式___。
(6)参照本题信息,试写出以1丁烯为原料制取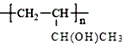 的合成路线流程图(无机原料任选)___。
的合成路线流程图(无机原料任选)___。
合成路线流程图示例如图:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com