
【题目】酸性KMnO4溶液和CuS混合时,发生的反应如下:MnO4-+CuS+H+→Cu2++SO2↑+Mn2++H2O,下列有关该反应的说法中正确的是( )
A.被氧化的元素是Cu和S
B.![]() 的还原性强于CuS的还原性
的还原性强于CuS的还原性
C.氧化剂与还原剂的物质的量之比为6:5
D.若生成2.24LSO2,转移电子的物质的量是6mol
【答案】C
【解析】
MnO4-+CuS+H+→Cu2++SO2↑+Mn2++H2O中,Mn元素的化合价由+7降低到+2,Cu元素的化合价不变,S元素的化合价由-2升高到+4,由此分析解答。
A、Cu元素化合价没有变化,被氧化的元素只有S,故A错误;
B、还原剂为CuS,还原产物为Mn2+,根据氧化还原反应规律,故还原性:CuS>Mn2+,故B错误;
C、氧化剂为MnO4-,还原剂为CuS,Mn元素的化合价降低5价,S元素化合价升高6价,根据氧化还原反应化合价升降守恒可知,氧化剂与还原剂的物质的量之比为6:5,故C正确;
D、因为未告知环境是否为标准状况,无法判断2.24 LSO2所对应的物质的量,故无法计算转移电子数目,故D错误。


科目:高中化学 来源: 题型:
【题目】水是生命之源。从某些方面看,NH3与H2O 相当,NH4+ 和H3O+(常简写为 H+ )相当;NH2-和OH-相当;NH2-(有时还包括 N3-)和 O2-相当。
(1)已知 Ca + 2H2O = Ca (OH)2 + H2↑,Ca 与液氨反应生成 H2 和______ (填生成物的化学式)。
(2)-78℃时,NH3 和 PCl3 在某种溶剂中发生复分解反应生成一种含磷化合物 A(摩尔质量 为 79 g/mol)。A 不稳定,易分解为黄色物质B,B中磷的质量分数为 68.89%。写出 A 分解为 B 的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是 ( )
A.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.往氨水中滴加氯化铝:Al3++4OH-=[Al(OH)]4-
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地売中含量最多的金属元素,自然界中主要以Al2O3的形式存在于铝土矿中。工业上以铝土矿(主要成分是A12O3,杂质有SiO2、Fe2O3等)为原料制备金属铝,其工艺流程如图所示:
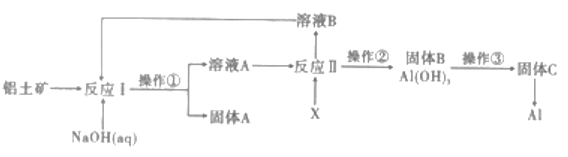
(1)操作①的名称是_________,实验室完成该操作所需的玻璃仪器主要有_________。
(2)为了提高反应的反应速率,可采取的措施有___________(答两条)
(3)调控反应I中钠铝元素之比一定时,Al2O3溶于NaOH,SiO2转化为铝硅酸钠沉淀。Al2O3与NaOH溶液反应的离子方程式为____________________。
(4)固体C→Al的化学反应方程式为__________________________。
(5)该生产过程中,需向反应Ⅱ中加入X
①X可为过量的CO2,则溶液B中主要的溶质是__________,为了使溶液B循环利用,应补充的物质是____________(填序号)
a. CaO b. HCl c. Na2 CO3
②X也可为少量Al(OH)3晶种(晶种可加速沉淀的生成),其优点是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
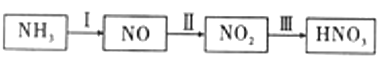
【题目】硝酸工业与合成氨工业密切相关,氨氧化法是工业生产中制取硝酸的主要途径,其主要流程如图:
I. 在一容积为2L的密闭容器内加入2molN2和6molH2,在一定条件下合成氨气,已知N2(g)+3H2(g)![]() 2NH3 △H<0。反应中NH3的物质的量浓度的变化情况如图所示
2NH3 △H<0。反应中NH3的物质的量浓度的变化情况如图所示

(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为______
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为________(填序号)。
a. 0. 8mol/L b.1.0mol/L. c.1.2mol/L d. 2. mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_________(选填“大于”“等于”或“小于”)二分之一倍的原体积。
Ⅱ.某小组同学欲探究由NH3制取HNO3的过程,设计按如图所示装置进行试验。
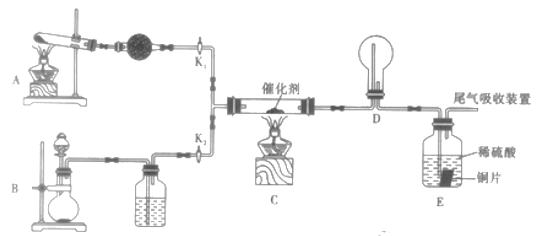
(1)A装置中发生反应的化学方程式为_________________________________。
(2)B装置制备的物质为_________________。(填序号)
A . NH3 B Cl2 C.O2 D. HCl
(3)该实验中能够证明有二氧化氮产生的现象为_______________________。
(4)已知E中装有2mol/L的硫酸150mL和足量铜片,若E中出现溶液变蓝色的现象,所有反应的铜均转化为CuSO4,则至少需要产生标况下_______L氨气(假设各步反应均完全进行)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列正确的叙述有( )
①CO2、NO2、P2O5均为酸性氧化物,MgO、Fe2O3、Na2O2均为碱性氧化物
②Ca(HCO3)2 、FeS、FeCl3均可由化合反应制得
③按照纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是CuSO4·5H2O、盐酸、苛性钾、次氯酸、氨气
④需要通电才可进行的有:电离、电解、电泳
A.1个B.2个C.3个D.4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积和物质的量浓度均相同的两份Ba(OH)2溶液中,分别滴入等物质的量浓度的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图A、B所示。(忽略温度和体积变化)

(1)曲线B表示滴加的溶液为_________。
(2)d点溶液导电性最弱的原因为__________;ac段发生反应的离子方程式为___________。
(3)曲线A中b点溶液的pH_______曲线B中b点溶液的pH(填“大于”、“小于”或“等于” );a点和c点加入溶液的体积比为_________。
(4)向NaHSO4溶液中滴加Ba(OH)2溶液至溶液恰好呈中性,继续滴加Ba(OH)2溶液时发生反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
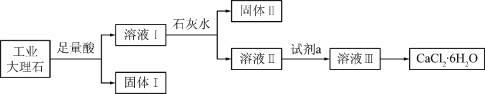
下列说法不正确的是
A. 固体I中含有SiO2,固体II中含有Fe(OH)3
B. 使用石灰水时,要控制pH,防止固体II中Al(OH)3转化为AlO2-
C. 试剂a选用盐酸,从溶液III得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D. 若改变实验方案,在溶液I中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下为中学化学中常见的几种物质:①NaOH溶液②铜丝③蔗糖晶体④无水乙醇⑤稀硫酸⑥液氨⑦氨水⑧SO2 ⑨硫酸钡晶体⑩熔融 NaC1,上述状态下可导电的________;上述状态下的电解质不能导电是__________________
(2)写出⑤和⑦发生反应的离子方程式___________________.
(3)在aLAl2(SO4)3和(NH4)2SO4的混合溶液中加入bmol BaCl2,恰好使溶液中的SO42-完全沉淀;若加入足量NaOH 并加热可得到c molNH3,则原溶液中 A13+的物质的量浓度为_____________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com