
【题目】水是生命之源。从某些方面看,NH3与H2O 相当,NH4+ 和H3O+(常简写为 H+ )相当;NH2-和OH-相当;NH2-(有时还包括 N3-)和 O2-相当。
(1)已知 Ca + 2H2O = Ca (OH)2 + H2↑,Ca 与液氨反应生成 H2 和______ (填生成物的化学式)。
(2)-78℃时,NH3 和 PCl3 在某种溶剂中发生复分解反应生成一种含磷化合物 A(摩尔质量 为 79 g/mol)。A 不稳定,易分解为黄色物质B,B中磷的质量分数为 68.89%。写出 A 分解为 B 的化学方程式:______________。
【答案】Ca(NH2)2 P(NH2)3=PN+2NH3↑
【解析】
(1)由题意,因NH3与H2O 相当,NH4+ 和H3O+(常简写为 H+ )相当;NH2-和OH-相当;,因此液氨的电离方程式可表示为:2NH3NH4++NH2,类比Ca + 2H2O = Ca (OH)2 + H2↑的反应,则金属钙与液氨的反应方程式为:Ca+2NH3═Ca(NH2)2+H2↑,
故答案为:Ca(NH2)2;
(2)由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应;结合液氨的电离方程式:2NH3NH4++NH2可得:PCl3和NH3反应生成P(NH2)3和NH4Cl,化学反应方程式为PCl3+NH3=P(NH2)3+NH4Cl,A是一种含磷化合物,故A为P(NH2)3,A不稳定易分解为黄色物质B,B中磷的质量分数为 68.89%,则B的摩尔质量=![]() g/mol=45 g/mol,则45 g/mol -31 g/mol =14 g/mol,则可确定B中还含有N,且化学式为PN,根据物料守恒,则A 分解为 B 的化学方程式:P(NH2)3=PN+2NH3↑,
g/mol=45 g/mol,则45 g/mol -31 g/mol =14 g/mol,则可确定B中还含有N,且化学式为PN,根据物料守恒,则A 分解为 B 的化学方程式:P(NH2)3=PN+2NH3↑,
故答案为:P(NH2)3=PN+2NH3↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有以下十种物质:①稀H2SO4②纯醋酸(CH3COOH)③NaOH溶液④FeCl3固体⑤CaCO3固体⑥CO2⑦熔融NaHSO4⑧Ba(HCO3)2溶液⑨乙醇(C2H5OH)⑩NH3H2O请回答下列问题
(1)其中能导电的是______;其中属于非电解质的是______;属于弱电解质的是______。(填序号)
(2)将题中④物质溶于水配成饱和溶液,滴入沸水中,继续煮沸至出现红褐色可制得Fe(OH)3胶体,写出该过程的化学方程式______。
(3)按要求写出题中各物质发生反应的离子方程式
①与⑧反应______;
②的水溶液与⑤的反应______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的。将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,不会出现的现象是( )
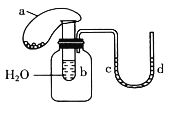
A.气球a变大
B.试管b内有气泡冒出
C.U形管内浅红色褪去
D.U形管水位d高于c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在初始温度为500℃、容积恒定为10L的三个密闭容器中,按图所示投入原料,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析不正确的是
CH3OH(g)+H2O(g) △H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析不正确的是
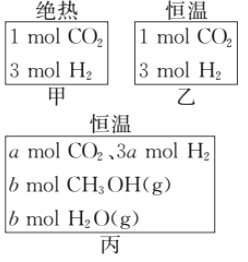
A. 刚开始反应时速率:甲=乙
B. 平衡后反应放热:甲<乙
C. 500℃时乙容器中反应的平衡常数:K=3×102
D. 若a≠0,则0.9<b<l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某软锰矿的主要成分为![]() ,还含有
,还含有![]() 等杂质,用该软锰矿制备
等杂质,用该软锰矿制备![]() 的流程图如图:
的流程图如图:
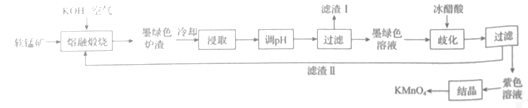
已知:I.![]() 固体和溶液均为黑绿色;
固体和溶液均为黑绿色;
II.![]() 溶液中存在以下平衡:
溶液中存在以下平衡:![]()
回答下列问题:
(1)“熔融煅烧”时,![]() 参与反应的化学方程式为_____。
参与反应的化学方程式为_____。
(2)“浸取“过程中,为加快浸取速率。可以采取的措施有____(写出两点)。向浸取液中通入![]() 调节其pH,经“过滤”得滤渣I,滤渣I的成分是____(填化学式)。
调节其pH,经“过滤”得滤渣I,滤渣I的成分是____(填化学式)。
(3)“歧化”时,加入冰醋酸的目的是____。“歧化”时,下列酸可以用来代替冰醋酸的有____(填字母)。
a.乙二酸 b.亚硫酸 c.氢溴酸 d.稀硫酸
(4)“结晶”时,当___时,停止加热,自然冷却,抽滤后即可获得紫黑色![]() 晶体。
晶体。
(5)已知![]() 能与热的硫酸酸化的
能与热的硫酸酸化的![]() 反应生成
反应生成![]() 和
和![]() 。取上述制得的
。取上述制得的![]() 产品7.0g,恰好与13.4g
产品7.0g,恰好与13.4g![]() 完全反应,则
完全反应,则![]() 的纯度为____%(结果保留1位小数)。
的纯度为____%(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取3mL 5mol·L-1 H2O2溶液,加入少量MnO2粉末,2min时c(H2O2)降为1mol·L-1。下列说法不正确的是
A.2min内,v(H2O2) =2molL-lmin-1
B.MnO2是催化剂,能加快H2O2的分解速率
C.升高温度或增大H2O2的浓度,均能加快H2O2的分解速率
D.若将5 molL-l H2O2溶液的体积增至6mL,则H2O2的分解速率增至原来的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物 NaBH4(B元素的化合价为+3价)和 H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用 MnO 2,可用作空军通信卫星电源,其工作原理如图所示。 下列说法不正确的是

A. 电极a采用Pt/C,电极b采用 MnO2
B. 电池放电时 Na +从b极区移向a极区
C. 负极电极反应式为:BH4- +8OH- -8e-=BO2-+6H2O
D. 反应中每消耗3mo lH2O2,转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雄黄 (As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为______。
(2)上述反应中的氧化剂是_____,反应产生的气体可用____吸收。
(3)As2S3和HNO3有如下反应:As2S3 + 10H+ + 10NO3- = 2H3AsO4+ 3S+10NO2↑+ 2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为____。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量_____(填字母)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性KMnO4溶液和CuS混合时,发生的反应如下:MnO4-+CuS+H+→Cu2++SO2↑+Mn2++H2O,下列有关该反应的说法中正确的是( )
A.被氧化的元素是Cu和S
B.![]() 的还原性强于CuS的还原性
的还原性强于CuS的还原性
C.氧化剂与还原剂的物质的量之比为6:5
D.若生成2.24LSO2,转移电子的物质的量是6mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com