
【题目】雄黄 (As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为______。
(2)上述反应中的氧化剂是_____,反应产生的气体可用____吸收。
(3)As2S3和HNO3有如下反应:As2S3 + 10H+ + 10NO3- = 2H3AsO4+ 3S+10NO2↑+ 2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为____。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量_____(填字母)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
【答案】1:1 As2S3 氢氧化钠溶液或硫酸铜溶液 10mol a
【解析】
(1)根据氧化还原反应得失电子数相等计算;
(2)反应中的氧化剂化合价降低,得电子被还原;酸性气体用碱液吸收法或者生成沉淀。
(3)根据化合价的变化计算;
(4)根据4NO2+O2+2H2O=4HNO3,C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O计算;
CO2↑+4NO2↑+2H2O计算;
(1)根据电子得失守恒知1molAs2S3作氧化剂得到2mol电子,而1molSnCl2作还原剂失去2mol电子,所以二者的物质的量之比是1:1;
答案:1:1
(2)反应中As元素化合价降低,As2S3为氧化剂,H2S为酸性气体,可用NaOH溶液或硫酸铜溶液吸收;
答案:As2S3 氢氧化钠溶液或硫酸铜溶液
(3)反应As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O中,As元素化合价由+3价升高到+5价,S元素化合价由-2价升高到0价,则生成2mol H3AsO4,转移电子为2×2mol+3×2mol=10mol;
答案:10mol
(4)根据4NO2+O2+2H2O=4HNO3,C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O可得,反应的关系式为O2~4HNO3~CO2,n(O2)=
CO2↑+4NO2↑+2H2O可得,反应的关系式为O2~4HNO3~CO2,n(O2)=![]() =0.5mol,根据电子守恒可知生成CO2的量是0.5mol,但考虑到随着反应到进行,硝酸的浓度会降低而稀硝酸不与碳反应,则生成的二氧化碳的物质的量少于0.5mol,故a正确;
=0.5mol,根据电子守恒可知生成CO2的量是0.5mol,但考虑到随着反应到进行,硝酸的浓度会降低而稀硝酸不与碳反应,则生成的二氧化碳的物质的量少于0.5mol,故a正确;
答案:a


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】下图为实验室制取氯气及探究Cl2性质装置图:
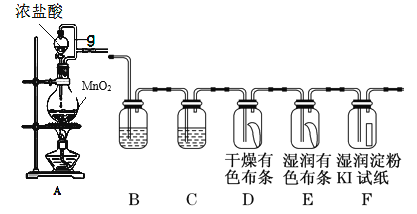
(1)装置A中的反应方程式是________;g的作用________。
(2)装置B的作用_______;装置C中的试剂为________。
(3)装置E的现象________。
(4)装置F中的反应方程式是________ 。
(5)该装置的缺陷是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源。从某些方面看,NH3与H2O 相当,NH4+ 和H3O+(常简写为 H+ )相当;NH2-和OH-相当;NH2-(有时还包括 N3-)和 O2-相当。
(1)已知 Ca + 2H2O = Ca (OH)2 + H2↑,Ca 与液氨反应生成 H2 和______ (填生成物的化学式)。
(2)-78℃时,NH3 和 PCl3 在某种溶剂中发生复分解反应生成一种含磷化合物 A(摩尔质量 为 79 g/mol)。A 不稳定,易分解为黄色物质B,B中磷的质量分数为 68.89%。写出 A 分解为 B 的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A2(g)+B2(g) →2AB(g)的能量变化如图所示,叙述正确的是

A. 该反应是放热反应
B. 加入催化剂,(b-a)的差值减小
C. 每生成2molAB分子吸收bkJ热量
D. 若反应生成AB为液态,吸收的热量小于(a-b)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸。原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子,乳酸的摩尔质量为90g/mol,下列有关说法中正确的是( )

A. 电极a为阴极,放出H2
B. 通电一段时间后,硫酸溶液的pH升高
C. A-通过阴离子交换膜从阴极进入浓缩室
D. 对400mLl0g/L乳酸溶液通电后,当外电路通过0.5mole-时浓度,上升为145g.L-1(溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中国在南极建设的第四个科学考察站——泰山站。为了延长科学考察站基础设施使用寿命,钢铁设备表面镶嵌一些金属块(M)。下列说法正确的是

A. 金属块M可能是铜,发生氧化反应
B. 这种保护方法叫牺牲阳极的阴极保护法
C. 科考考察站里的设备在潮湿空气中主要发生化学腐蚀
D. 若采用外加电流的阴极保护法,设备与电源正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是 ( )
A.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.往氨水中滴加氯化铝:Al3++4OH-=[Al(OH)]4-
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地売中含量最多的金属元素,自然界中主要以Al2O3的形式存在于铝土矿中。工业上以铝土矿(主要成分是A12O3,杂质有SiO2、Fe2O3等)为原料制备金属铝,其工艺流程如图所示:
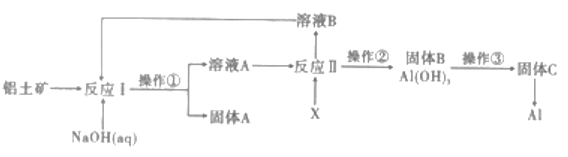
(1)操作①的名称是_________,实验室完成该操作所需的玻璃仪器主要有_________。
(2)为了提高反应的反应速率,可采取的措施有___________(答两条)
(3)调控反应I中钠铝元素之比一定时,Al2O3溶于NaOH,SiO2转化为铝硅酸钠沉淀。Al2O3与NaOH溶液反应的离子方程式为____________________。
(4)固体C→Al的化学反应方程式为__________________________。
(5)该生产过程中,需向反应Ⅱ中加入X
①X可为过量的CO2,则溶液B中主要的溶质是__________,为了使溶液B循环利用,应补充的物质是____________(填序号)
a. CaO b. HCl c. Na2 CO3
②X也可为少量Al(OH)3晶种(晶种可加速沉淀的生成),其优点是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
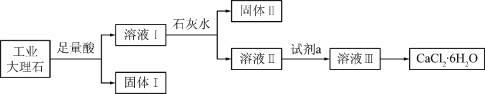
下列说法不正确的是
A. 固体I中含有SiO2,固体II中含有Fe(OH)3
B. 使用石灰水时,要控制pH,防止固体II中Al(OH)3转化为AlO2-
C. 试剂a选用盐酸,从溶液III得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D. 若改变实验方案,在溶液I中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com