
【题目】下图为实验室制取氯气及探究Cl2性质装置图:
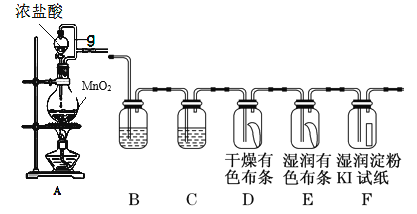
(1)装置A中的反应方程式是________;g的作用________。
(2)装置B的作用_______;装置C中的试剂为________。
(3)装置E的现象________。
(4)装置F中的反应方程式是________ 。
(5)该装置的缺陷是________。
【答案】MnO2 +4HCl(浓)![]() MnCl2 +Cl2 ↑+2H2O 平衡压强,使液体顺利滴下 除去Cl2中的HCl 浓硫酸 湿润的有色布条褪色 Cl2+2KI=2KCl+I2 没有安装尾气处理装置
MnCl2 +Cl2 ↑+2H2O 平衡压强,使液体顺利滴下 除去Cl2中的HCl 浓硫酸 湿润的有色布条褪色 Cl2+2KI=2KCl+I2 没有安装尾气处理装置
【解析】
在装置A中MnO2与浓盐酸反应产生Cl2,由于浓盐酸具有挥发性,制取得到的Cl2中含有杂质HCl及水蒸气,通过B中饱和NaCl溶液除去HCl,通过C中的浓硫酸除去水蒸气,通过D、E验证具有漂白性的物质的成分,在F中Cl2与KI发生置换反应,产生I2使淀粉试纸变为蓝色,Cl2是大气污染物,在尾气排放前要进行尾气处理。
(1)装置A中MnO2与浓盐酸混合加热,发生氧化还原反应产生Cl2,反应的化学方程式是MnO2 +4HCl(浓)![]() MnCl2 +Cl2 ↑+2H2O;g将分液漏斗上下连接在一起,使液体上下气体压强相同,这样浓盐酸在重力作用下就可以顺利滴下,故g的作用是平衡压强,使液体顺利滴下;
MnCl2 +Cl2 ↑+2H2O;g将分液漏斗上下连接在一起,使液体上下气体压强相同,这样浓盐酸在重力作用下就可以顺利滴下,故g的作用是平衡压强,使液体顺利滴下;
(2)装置B的作用除去Cl2中的混合的杂质气体HCl;装置C的作用是干燥Cl2,其中的试剂为浓硫酸;
(3)D中干燥的纯净的氯气不能使干燥的有色布条褪色,而在装置E中,Cl2与布条上的水发生反应产生HCl、HClO,HClO具有强的氧化性,会将有色物质氧化为无色物质,因此观察到E中潮湿的有色布条褪色;
(4)由于氧化性Cl2>I2,所以在装置F中发生置换反应,反应方程式是Cl2+2KI=2KCl+I2;
(5)Cl2是有毒气体,直接排放会造成大气污染,所以该装置的缺陷没有安装尾气处理装置。


科目:高中化学 来源: 题型:
【题目】铜与稀硝酸反应制备NO是化学实验教学中的重要实验之一,但是由于反应进度不易控制、NO易被氧化以及容易造成空气污染等原因在教学实践中不易操作,如图为该实验进行改进示意图。回答下列问题:

(1)组装实验装置并检验装置的气密性,检验气密性的方法为___。
(2)如果该装置气密性良好,如图装好药品,并能保证B中的两根玻璃导管能穿过塑料隔板,然后在塑料隔板上添加铜片,在反应发生前需要进行的必要操作为:打开试管C上部的止水夹,从A口通入__气体,当__时,停止从A口通气体,并用止水夹夹住A口的橡胶管。
(3)引发Cu与稀HNO3反应发生的操作:__。
(4)B中的实验现象:___。
(5)简述使实验停止的操作:___。
(6)实现无色气体迅速变为红棕色的操作:____。
(7)澄清石灰水和蘸有NaOH溶液的棉花团都可以吸收尾气,若NaOH溶液吸收NO和NO2混合气体后无气体剩余,请写出发生反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下十种物质:①稀H2SO4②纯醋酸(CH3COOH)③NaOH溶液④FeCl3固体⑤CaCO3固体⑥CO2⑦熔融NaHSO4⑧Ba(HCO3)2溶液⑨乙醇(C2H5OH)⑩NH3H2O请回答下列问题
(1)其中能导电的是______;其中属于非电解质的是______;属于弱电解质的是______。(填序号)
(2)将题中④物质溶于水配成饱和溶液,滴入沸水中,继续煮沸至出现红褐色可制得Fe(OH)3胶体,写出该过程的化学方程式______。
(3)按要求写出题中各物质发生反应的离子方程式
①与⑧反应______;
②的水溶液与⑤的反应______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
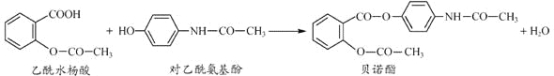
下列有关叙述正确的是( )
A. 贝诺酯分子中有三种含氧官能团
B. 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C. 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D. 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了前20号元素中的某些元素性质的有关数据:
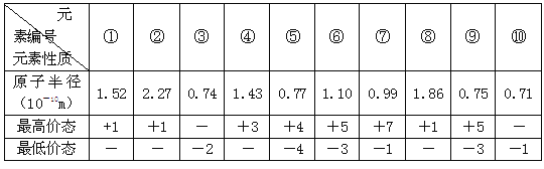
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是____________(填写编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是______(写分子式)。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于______;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式______。
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为______。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 如图所示为二维平面晶体示意图,所表示的化学式为AX3的是________。

(2) 下图为一个金属铜的晶胞,请完成以下各题。

① 该晶胞“实际”拥有的铜原子数是________个。
② 该晶胞称为________(填序号)。
A.六方晶胞 B.体心立方晶胞
C.面心立方晶胞 D.简单立方晶胞
③此晶胞立方体的边长为a cm,Cu的相对原子质量为64 g·mol-1,金属铜的密度为ρ g·cm-3,则阿伏加德罗常数为________(用a、ρ表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的。将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,不会出现的现象是( )
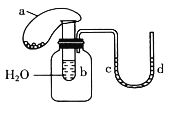
A.气球a变大
B.试管b内有气泡冒出
C.U形管内浅红色褪去
D.U形管水位d高于c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在初始温度为500℃、容积恒定为10L的三个密闭容器中,按图所示投入原料,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析不正确的是
CH3OH(g)+H2O(g) △H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析不正确的是
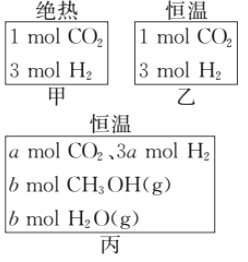
A. 刚开始反应时速率:甲=乙
B. 平衡后反应放热:甲<乙
C. 500℃时乙容器中反应的平衡常数:K=3×102
D. 若a≠0,则0.9<b<l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雄黄 (As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为______。
(2)上述反应中的氧化剂是_____,反应产生的气体可用____吸收。
(3)As2S3和HNO3有如下反应:As2S3 + 10H+ + 10NO3- = 2H3AsO4+ 3S+10NO2↑+ 2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为____。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量_____(填字母)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com