
【题目】铝是地売中含量最多的金属元素,自然界中主要以Al2O3的形式存在于铝土矿中。工业上以铝土矿(主要成分是A12O3,杂质有SiO2、Fe2O3等)为原料制备金属铝,其工艺流程如图所示:
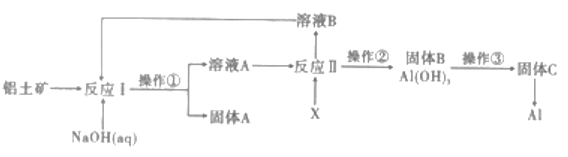
(1)操作①的名称是_________,实验室完成该操作所需的玻璃仪器主要有_________。
(2)为了提高反应的反应速率,可采取的措施有___________(答两条)
(3)调控反应I中钠铝元素之比一定时,Al2O3溶于NaOH,SiO2转化为铝硅酸钠沉淀。Al2O3与NaOH溶液反应的离子方程式为____________________。
(4)固体C→Al的化学反应方程式为__________________________。
(5)该生产过程中,需向反应Ⅱ中加入X
①X可为过量的CO2,则溶液B中主要的溶质是__________,为了使溶液B循环利用,应补充的物质是____________(填序号)
a. CaO b. HCl c. Na2 CO3
②X也可为少量Al(OH)3晶种(晶种可加速沉淀的生成),其优点是___________________。
【答案】过滤 烧杯、玻璃棒、漏斗 适当增加碱溶液的浓度,将铝土矿粉碎,搅拌,加热等 Al2O3+2OH=2AlO+H2O 2Al2O3(熔融) ![]() 4Al+3O2↑ NaHCO3 a 溶液B可直接循环使用
4Al+3O2↑ NaHCO3 a 溶液B可直接循环使用
【解析】
用NaOH溶液溶解铝土矿(主要成分是A12O3,杂质有SiO2、Fe2O3等),并调控钠铝元素之比,使Al2O3溶于NaOH,SiO2转化为铝硅酸钠沉淀,则过滤后得到固体A为铝硅酸钠和Fe2O3,溶液A中主要含有NaAlO2,向溶液A中通入过量CO2气体,得Al(OH)3沉淀和NaHCO3溶液,过滤后所得滤液B主要含有NaHCO3,加入CaO可制得NaOH,循环利用,将沉淀B加热灼烧得固体C为Al2O3,再电解可得Al,据此流程分析解题。
(1)操作①的目的是固液分离,应为过滤,该操作所需的玻璃仪器主要有烧杯、玻璃棒、漏斗;
(2)利用增加碱溶液的浓度,将铝土矿粉碎,搅拌,加热等措施,可提高反应的反应速率;
(3)Al2O3与NaOH溶液反应生成偏铝酸钠,反应的离子方程式为Al2O3+2OH=2AlO+H2O;
(4)利用电解Al2O3生成Al,发生反应的化学方程式为2Al2O3(熔融) ![]() 4Al+3O2↑;
4Al+3O2↑;
(5)①偏铝酸钠与过量的CO2反应生成碳酸氢钠,碳酸氢钠与氧化钙反应生成氢氧化钠,可循环使用,故答案为a;
②因Al(OH)3晶种可加速沉淀的生成,偏铝酸钠水解生成氢氧化铝和氢氧化钠,所以溶液B可直接循环使用。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在初始温度为500℃、容积恒定为10L的三个密闭容器中,按图所示投入原料,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析不正确的是
CH3OH(g)+H2O(g) △H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析不正确的是
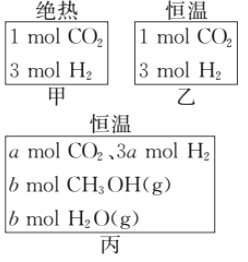
A. 刚开始反应时速率:甲=乙
B. 平衡后反应放热:甲<乙
C. 500℃时乙容器中反应的平衡常数:K=3×102
D. 若a≠0,则0.9<b<l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雄黄 (As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为______。
(2)上述反应中的氧化剂是_____,反应产生的气体可用____吸收。
(3)As2S3和HNO3有如下反应:As2S3 + 10H+ + 10NO3- = 2H3AsO4+ 3S+10NO2↑+ 2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为____。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量_____(填字母)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知:δ(X)=![]() ]。下列叙述错误的是
]。下列叙述错误的是

A. K1(H2A)=10-1.2
B. pH=2.7时,c(H2A)+c(HA-)+c(A2-)=0.1 mol·L-1
C. pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D. pH=4.2时,c(HA-)=c(A2-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、Cu2+、CO32—、SO42—、NO3—中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法错误的是
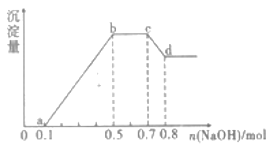
A. 溶液中的阳离子有H+、Mg2+、Al3+、NH4+
B. cd段的离子方程式为Al(OH)3+OH—=AlO2—+2H2O
C. 溶液中n(NH4+)=0.2mol
D. n(H+):n(Mg2+):n(Al3+)=1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空
(1)写出下列物质在水溶液中的电离方程式:
NaHCO3__________________
KHSO4________________________________________________
CH3COOH____________________________
Al(OH)3 ________________
(2)写出下列反应的离子方程式:
稀盐酸与碳酸钙反应_____________
氢氧化铜溶液与稀硫酸反应______________
氯气和水反应_____________
氧化镁与稀硫酸反应_________________
(3)写出与下列离子方程式相对应的化学方程式:
H+ + OH- =H2O _____________
CO32- + 2H+=CO2↑+ H2O_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性KMnO4溶液和CuS混合时,发生的反应如下:MnO4-+CuS+H+→Cu2++SO2↑+Mn2++H2O,下列有关该反应的说法中正确的是( )
A.被氧化的元素是Cu和S
B.![]() 的还原性强于CuS的还原性
的还原性强于CuS的还原性
C.氧化剂与还原剂的物质的量之比为6:5
D.若生成2.24LSO2,转移电子的物质的量是6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作____剂。
(2)自然界Cr主要以+3价和+6价存在。Cr2O72-的Cr能引起细胞的突变,在酸性条件下可以用亚硫酸钠将其还原为+3价的铬,写出其离子方程式_____________________________________________ :
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是______________。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:

①上述操作中有多次过滤,其中玻璃棒的作用__________ ,向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为____。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是____。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是( )
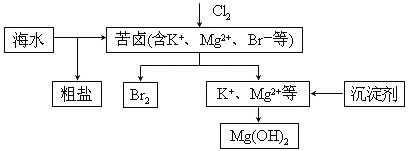
A. 向苦卤中通入Cl2是为了提取溴
B. 工业生产中常选用NaOH作为沉淀剂
C. 粗盐可采用除杂和重结晶等过程提纯
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用![]() 将其还原吸收
将其还原吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com