
【题目】改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知:δ(X)=![]() ]。下列叙述错误的是
]。下列叙述错误的是

A. K1(H2A)=10-1.2
B. pH=2.7时,c(H2A)+c(HA-)+c(A2-)=0.1 mol·L-1
C. pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D. pH=4.2时,c(HA-)=c(A2-)=c(H+)
【答案】D
【解析】
由图象可知,pH=1.2时,c(H2A)=c(HA-),PH=2.7时,c(H2A)=c(A2-),pH=4.2时,c(HA-)=c(A2-),随着pH的增大,c(H2A)逐渐减小,c(HA-)先增大后减小,c(A2-)逐渐增大,结合电离平衡常数以及题给数据计算,可根据纵坐标比较浓度大小,以此解答该题.
A.由图象可知pH=1.2时,H2A与HA-的曲线相交,则c(H2A)=c(HA-),所以![]() =c(H+)=10-1.2,故不符合题意;
=c(H+)=10-1.2,故不符合题意;
B.根据物料守恒c(H2A)+c(HA-)+c(A2-)=0.1mol/L,故不符合题意;
C.由图象可知,PH=2.7时,c(H2A)=c(A2-),由纵坐标数据可知c(HA-)>c(H2A)= c(A2-),故不符合题意;
D.pH=4.2时,c(HA-)=c(A2-),但此时c(H2A)![]() 0,如体积不变,则c(HA-)=c(A2-)=0.05mol/L,c(H+)=10-4.2mol/L;如体积变化,则不能确定c(HA-)、c(A2-)与c(H+)浓度大小关系,故符合题意。
0,如体积不变,则c(HA-)=c(A2-)=0.05mol/L,c(H+)=10-4.2mol/L;如体积变化,则不能确定c(HA-)、c(A2-)与c(H+)浓度大小关系,故符合题意。
故选D。


科目:高中化学 来源: 题型:
【题目】根据下列结构示意图,判断下列说法中正确的是
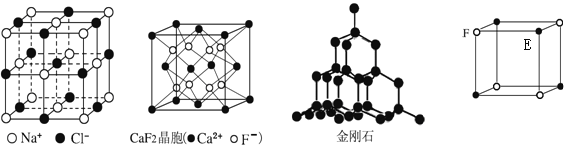
A. 在NaCl晶体中,距Na+最近的多个Cl-构成正四面体
B. 在CaF2晶体中,Ca2+的配位数为4
C. 在金刚石晶体中,碳原子与碳碳键数之比为1:2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A2(g)+B2(g) →2AB(g)的能量变化如图所示,叙述正确的是

A. 该反应是放热反应
B. 加入催化剂,(b-a)的差值减小
C. 每生成2molAB分子吸收bkJ热量
D. 若反应生成AB为液态,吸收的热量小于(a-b)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中国在南极建设的第四个科学考察站——泰山站。为了延长科学考察站基础设施使用寿命,钢铁设备表面镶嵌一些金属块(M)。下列说法正确的是

A. 金属块M可能是铜,发生氧化反应
B. 这种保护方法叫牺牲阳极的阴极保护法
C. 科考考察站里的设备在潮湿空气中主要发生化学腐蚀
D. 若采用外加电流的阴极保护法,设备与电源正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是 ( )
A.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.往氨水中滴加氯化铝:Al3++4OH-=[Al(OH)]4-
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧氮杂是新药研制过程中发现的一类重要活性物质,能用于改善大脑缺血。下面是某研究小组提出的一种氧氮杂类化合物E的合成路线:
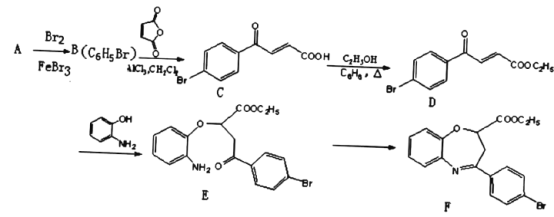
(1)A的结构简式为_____。C中官能团的名称为____。
(2)E→F经历两步反应,其反应类型依次为______、______。
(3)同时满足下列条件的D的一种同分异构体的结构简式为______。
I.分子中含有1个苯环;
II.能发生银镜反应;
III.分子中有5种不同化学环境的氢。
(4)1mol D与足量NaOH溶液反应时最多消耗_____molNaOH。
(5)由E合成F时还可能生成副产物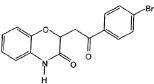 和一种常见的有机物G,G的结构简式为_______。
和一种常见的有机物G,G的结构简式为_______。
(6)已知: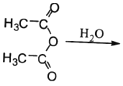 CH3COOH。原料
CH3COOH。原料![]() 俗名“马莱酐”,它是马莱酸
俗名“马莱酐”,它是马莱酸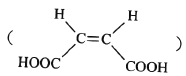 的酸酐。请写出以
的酸酐。请写出以![]() 为原料制备化合物
为原料制备化合物 的合成路线流程图(无机试剂任用)。______
的合成路线流程图(无机试剂任用)。______
合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() Br-CH2CH2-Br
Br-CH2CH2-Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地売中含量最多的金属元素,自然界中主要以Al2O3的形式存在于铝土矿中。工业上以铝土矿(主要成分是A12O3,杂质有SiO2、Fe2O3等)为原料制备金属铝,其工艺流程如图所示:
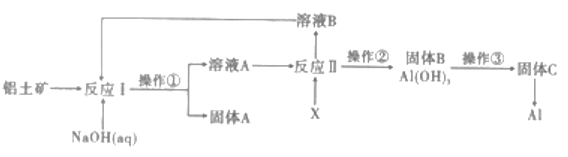
(1)操作①的名称是_________,实验室完成该操作所需的玻璃仪器主要有_________。
(2)为了提高反应的反应速率,可采取的措施有___________(答两条)
(3)调控反应I中钠铝元素之比一定时,Al2O3溶于NaOH,SiO2转化为铝硅酸钠沉淀。Al2O3与NaOH溶液反应的离子方程式为____________________。
(4)固体C→Al的化学反应方程式为__________________________。
(5)该生产过程中,需向反应Ⅱ中加入X
①X可为过量的CO2,则溶液B中主要的溶质是__________,为了使溶液B循环利用,应补充的物质是____________(填序号)
a. CaO b. HCl c. Na2 CO3
②X也可为少量Al(OH)3晶种(晶种可加速沉淀的生成),其优点是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列正确的叙述有( )
①CO2、NO2、P2O5均为酸性氧化物,MgO、Fe2O3、Na2O2均为碱性氧化物
②Ca(HCO3)2 、FeS、FeCl3均可由化合反应制得
③按照纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是CuSO4·5H2O、盐酸、苛性钾、次氯酸、氨气
④需要通电才可进行的有:电离、电解、电泳
A.1个B.2个C.3个D.4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室制氨气的化学方程式为_________________________。
(2)0.1 mol/LNH4Cl溶液中离子浓度由大到小的顺序为____________________。
(3)已知0.5mol的液态甲醇(CH3OH)在空气中完全燃烧生成CO2气体和液态水时放出350kJ的热量,则表示甲醇燃烧热的热化学方程式为______________________。
(4)已知①C(s)+O2(g)= CO2(g) ΔH1=-393 kJ/mol
②2CO(g)+O2(g)= 2CO2(g) ΔH2=-566 kJ/mol
③TiO2(s)+2Cl2(g)= TiCl4(s)+O2(g) ΔH3=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)= TiCl4(s)+2CO(g)的 ΔH =__________________。
(5)在25℃下,向浓度均为0.1 mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀_____(填化学式)(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20)。
(6)常温下,0.lmol/LNaHCO3溶液的pH大于8,则溶液中c(H2CO3)______c(CO32-)(填“>”、“=”或“<”)。
(7)在25℃下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应完成后溶液中c(NH4+)=c(Cl-),则溶液显_________性(填“酸”“碱”或“中”),a _________0.01 mol/L(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com