
【题目】在200mL含Mg2+、Al3+、NH4+、H+、Cl—等离子的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述正确的是( )

A. 原溶液中n(Mg2+):n(Al3+)=10:1 B. 原溶液中的c(H+)=0.02mol/L
C. x与y的差值为0.008mol D. 原溶液中c(Cl-)=0.6mol/L
【答案】C
【解析】
由图象和溶液中的离子可知,逐滴加入4molL-1的氢氧化钠溶液时,0~4mL发生H+与氢氧化钠的反应,4~30mL发生Mg2+、Al3+与氢氧化钠的反应生成沉淀,30~33mL发生NH4+与氢氧化钠的反应,33~35mL发生Al(OH)3与氢氧化钠的反应,然后进行计算即可解答。
由图象可知,x与y的差值即为Al(OH)3的物质的量,由Al(OH)3+NaOH=NaAlO2+2H2O,NaOH的物质的量为(35-33)mL×10-3L×4molL-1=0.008mol,即Al(OH)3的物质的量也为0.008mol,选项C正确;由Al3+~Al(OH)3,则n(Al3+)=0.008mol,4~30mL发生Mg2+、Al3+与氢氧化钠的反应生成沉淀,共消耗NaOH的物质的量为(30-4)mL×10-3L×4molL-1=0.104mol,Al3+消耗的NaOH的物质的量为0.008mol×3=0.024mol,则与Mg2+反应的NaOH的物质的量为0.104mol-0.024mol=0.08mol,由Mg2++2OH-═Mg(OH)2↓,n(Mg2+)=0.04mol,原溶液中n(Mg2+):n(Al3+)=0.04mol :0.008mol =5:1,选项A错误;0~4mL发生H+与氢氧化钠的反应,则H+的物质的量为4mL×10-3L×4molL-1=0.016mol,c(H+)=![]() =0.08mol/L,选项B错误;溶液中的阴离子只有Cl-,则加入33mLNaOH溶液时Cl-全部存在于NaCl中,则Cl-的物质的量为33mL×10-3L×4molL-1=0.132mol,原溶液中c(Cl-)=
=0.08mol/L,选项B错误;溶液中的阴离子只有Cl-,则加入33mLNaOH溶液时Cl-全部存在于NaCl中,则Cl-的物质的量为33mL×10-3L×4molL-1=0.132mol,原溶液中c(Cl-)=![]() =0.66mol/L,选项D错误;答案选C。
=0.66mol/L,选项D错误;答案选C。


科目:高中化学 来源: 题型:
【题目】反应:2X(g)+Y(g)2Z(g)在不同温度和压强下的产物Z的物质的量和反应时间t的关系如下图所示:下列判断正确的是( )
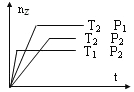
A. P1>P2 T1>T2 ΔH<0B. P1>P2 T1<T2 ΔH<0
C. P1>P2 T1>T2 ΔH>0D. P1<P2 T1<T2 ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于第ⅠA族和第ⅦA族元素的说法正确的是( )
①第ⅠA族元素都是金属元素
②第ⅠA族元素都能形成+1价的离子
③第ⅦA族元素的最高正价都为+7
④第ⅦA族元素简单气态氢化物的热稳定性逐渐减弱
A. ①③ B. ②③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. H2O、D2O和T2O三者中H、D、T互为同位素,所以这三者不是同一种物质
B. 正丁烷和异丁烷,白磷和红磷互为同分异构体
C. 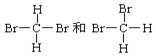 不是同分异构体
不是同分异构体
D. H2O 、Ne 和H2SO4都是只含共价键而不含离子键的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,已知:A是形成化合物种类最多的元素,它的一种同位素可用于鉴定文物年代; B2-离子与氩原子具有相同的电子层结构;C、D次外层电子都是8个,C和D的化合物CD在水溶液中能电离出的阳离子比阴离子少一个电子层;D的最高价与其负价的代数和为6。试写出:
(1)A位于元素周期表中第__周期____族,它用于鉴定文物年代的一种同位素为_____。
(2)D的气态氢化物的电子式为_____。
(3)B、C分别对应的最高价氧化物水化物之间反应的离子方程式______________。
(4)C所在族元素除______外,都叫______,试写出C与水反应的离子方程式_________;现有两种此族金属(一种在第五周期)形成的混合金属40g,当它与足量水反应时,放出标准状况下的氢气22.4L,则另一种金属是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,流程如下:

(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为 。能提高烧渣浸取速率的措施有 (填字母)。
A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是 (填字母)。

A.Fe粉 B.SO2 C.NaI
还原结束时,溶液中的主要阴离子有 。
(3)滤渣Ⅱ主要成分的化学式为 ;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是 、 过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X溶液中可能含有下列8种离子中的几种:Fe3+、Fe2+、Na+、NH4+、CO32、Cl、SO32、SO42。某同学为确定其成分,设计并完成以下实验(不考虑水解,所加试剂均足量):
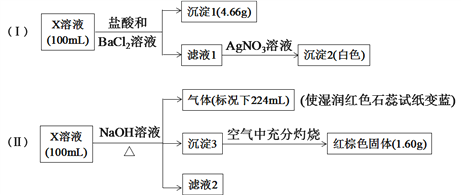
下列说法正确的是
A. X溶液中一定存在Na+、SO32、SO42、CO32
B. X溶液中一定存在NH4+、Na+、SO42,至少含有Fe3+、Fe2+离子中的一种
C. 取少量X溶液,先加入适量氯水,再加少量KSCN溶液,若溶液呈血红色,则含有Fe2+
D. X溶液中一定含有Cl,且c(Cl)≥0.1mol·L1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com