
【题目】有A、B、C、D四种元素,已知:A是形成化合物种类最多的元素,它的一种同位素可用于鉴定文物年代; B2-离子与氩原子具有相同的电子层结构;C、D次外层电子都是8个,C和D的化合物CD在水溶液中能电离出的阳离子比阴离子少一个电子层;D的最高价与其负价的代数和为6。试写出:
(1)A位于元素周期表中第__周期____族,它用于鉴定文物年代的一种同位素为_____。
(2)D的气态氢化物的电子式为_____。
(3)B、C分别对应的最高价氧化物水化物之间反应的离子方程式______________。
(4)C所在族元素除______外,都叫______,试写出C与水反应的离子方程式_________;现有两种此族金属(一种在第五周期)形成的混合金属40g,当它与足量水反应时,放出标准状况下的氢气22.4L,则另一种金属是_________。
【答案】2 IVA 14C ![]() H++OH- =H2O H (或氢) 碱金属 2Na+2H2O =2Na+ +2OH- +H2↑ Li (锂)
H++OH- =H2O H (或氢) 碱金属 2Na+2H2O =2Na+ +2OH- +H2↑ Li (锂)
【解析】
A是形成化合物种类最多的元素,它的一种同位素可用于鉴定文物年代,则A为C元素;B2-离子与氩原子具有相同的电子层结构,则B为S元素;设D的最高正价为+x,则其最低负价表示为x-8,D的最高价与其负价的代数和为6,所以x+x-8=6,解得x=7,故D的最高正价为+7价,则D为Cl元素;C、D次外层电子都是8个,C和D的化合物CD在水溶液中能电离出的阳离子比阴离子少一个电子层,则C为Na元素,据此答题。
由分析可知:A为C元素,B为S元素,C为Na元素,D为Cl元素。
(1)由分析可知A为C元素,位于元素周期表的第2周期第IVA族,用于鉴定文物年代的碳的同位素为14C,故答案为:2,IVA,14C。
(2)由分析可知D为Cl元素,其气态氢化物为HCl,H原子和Cl原子间形成1对共用电子对,电子式为:![]() ,故答案为:
,故答案为:![]() 。
。
(3)由分析可知:B为S元素,C为Na元素,B、C分别对应的最高价氧化物水化物分别为H2SO4和NaOH,H2SO4和NaOH发生酸碱中和反应生成硫酸钠和水,离子方程式为:H++OH- =H2O,故答案为:H++OH- =H2O。
(4)由分析可知C为Na元素,Na元素所在族元素除氢外,都是碱金属,钠与水反应生成氢氧化钠和水,反应的离子方程式2Na+2H2O=2Na+ +2OH- +H2↑,此族第五周期的元素是铷,铷与水反应的化学方程式为2Rb+2H2O=2RbOH+H2↑,生成氢气的物质的量为22.4L÷22.4L/mol=1mol,则2M+2H2O=2MOH+H2↑,则金属的平均摩尔质量为40g÷2mol=20g/mol。铷的摩尔质量为85.5g/mol,则另一种碱金属的摩尔质量一定小于20g/mol,所以另一碱金属只能是Li,故答案为:H(或氢),碱金属,2Na+2H2O =2Na+ +2OH- +H2↑,Li(锂)。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 11.2 L H2中含有氢原子的个数为NA
B. 在标准状况下,22.4 LCO2中含有共用电子对数为4NA
C. 78gNa2O2与少量CO2反应转移电子数为NA
D. 1 mol/L NaCl溶液中含有钠离子的个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 镀铜铁制品镀层破损后,铁制品比破损前更容易生锈
B. 标准状况下,22.4 L Cl2与足量NaOH溶液反应,转移电子数为2mol
C. 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
D. Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列化学反应方程式正确且能设计成原电池的是_________。
A.KOH + HCl = KCl + H2O B. Cu + Fe3+ = Fe2+ + Cu2+
C.Na2O + H2O = 2NaOH D.Fe + H2SO4 = FeSO4 + H2↑
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如下图)。有关实验现象,下列说法正确的是:______。
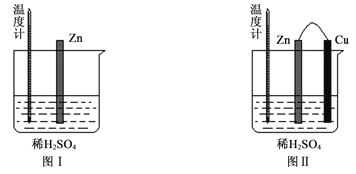
A.图I中温度计的示数高于图II的示数
B.图I和图II中温度计的示数相等,且均高于室温
C.图I和图II的气泡均产生于锌棒表面
D.图II中产生气体的速度比I慢
(3)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O
①写出放电时正极的电极反应式:___________;
②铅蓄电池放电时,负极质量将_______(填“增大”、“减小”或“不变”)。当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200mL含Mg2+、Al3+、NH4+、H+、Cl—等离子的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述正确的是( )

A. 原溶液中n(Mg2+):n(Al3+)=10:1 B. 原溶液中的c(H+)=0.02mol/L
C. x与y的差值为0.008mol D. 原溶液中c(Cl-)=0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl26H2O是一种饲料营养强化剂。可由水钴矿[主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等]制取,其工艺流程如下:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等。
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表。
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl26H2O熔点为86℃,加热至110﹣120℃时,失去结晶水生成CoCl2。
回答下列问题:
(1)浸出水钴矿过程中,Fe2O3发生反应的化学方程式为________________________。
(2)向浸出液中加入适量NaClO3目的是______________________________________。
(3)“加Na2CO3调pH至a”,a的范围是______;过滤所得沉淀的化学式为_________。
(4)萃取剂对金属离子的萃取与溶液pH的关系如下图所示,向“滤液”中加入该萃取剂的目的是_____,使用该萃取剂的最佳pH范围是_____(填选项字母,pH-萃取率见下)
A.5.0﹣5.5 B.4.0﹣4.5 C.3.0﹣3.5 D.2.0﹣2.5

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) △H=____kJ·mol-1。
CH3OCH3(g)+CO2(g) △H=____kJ·mol-1。
下列措施中,能提高CH3OCH3产率的有____。
A.使用合适的催化剂 B.升高温度 C.增大压强
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____。
A.△H < 0
B.P1<P2<P3
C.若在P3和316℃时,起始n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%

(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为____时最有利于二甲醚的合成。
(4)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,b电极的电极反应式为____。
(5)甲醇液相脱水法制二甲醚的原理是:
CH3OH +H2SO4 → CH3HSO4+H2O,
CH3 HSO4+CH3OH → CH3OCH3+H2SO4。
与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,产物中只能生成铁的+3价化合物的是
A.少量铁与稀硫酸反应
B.铁丝在氧气中燃烧
C.少量FeCl2溶液中通入过量氯气
D.Fe投入到CuSO4溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com